Diese neue wissenschaftliche Studie belegt die verbesserte Entwicklung von Fischeiern und Fischlarven bei Zierfischen (hier: bei Afrikanischen Cichliden) unter Verwendung von Huminstoffen.
Noch viel mehr zum Thema Huminstoffe im Aquarium findest Du in unserem Wiki-Hauptartikel:
Huminstoffe im Aquarium, Wasseraufbereiter Nr.1
Original-Artikel: Life 13(5):1071 • April 2023
Bearbeitung: Deutsche Überrsetzung
Lizenz: CC BY 4.0
Die Auswirkungen von Huminsäuren auf die frühen Entwicklungsstadien Afrikanischer Cichliden in der Nachzucht
Silvia Ondrašovičová1, František Zigo2, Július Gogolá3, Zuzana Lacková2, Zuzana Farkašová2, Juliana Arvaiová2, Viera Almášiová4 und Ibrahim F. Rehan5,6
1 Abteilung für Biologie und Physiologie der Veterinärmedizinischen und Pharmazeutischen Universität, Komenského 73, 041 81 Košice, Slowakei
2 Abteilung für Ernährung und Tierzucht der Veterinärmedizinischen und Pharmazeutischen Universität, Komenského 73, 041 81 Košice, Slowakei
3 Private tierärztliche Klinik, Zvolenská Slatina SNP 367/25, 962 01 Zvolen, Slowakei
4 Abteilung für morphologische Disziplinen der Veterinärmedizinischen und Pharmazeutischen Universität Košice, Komenského 73, 041 81 Košice, Slowakei
5 Abteilung für Tierhaltung und Entwicklung der Tiergesundheit, Fakultät der Veterinärmedizin der Minufiya-Universität, Shebin Alkom 32511, Ägypten
6 Abteilung für Pathobiochemie, Fakultät der Pharmazie der Meijo-Universität, Yagotoyama 150, Tempaku-ku, Nagoya-shi 468-8503, Japan
Kurzbeschreibung: Das Ziel dieser Studie war ein Vergleich des Effekts von durch einen Auszug aus Alginat gewonnener Huminsäure (HS) auf die Bebrütung von Fischrogen und die Larvalentwicklung afrikanischer Cichliden (Labidochromis caeruleus) sowie ihr Einfluss auf die Stabilisierung der physikalisch-chemischen Parameter des Wassers in einem Aquarium während der künstlichen Aufzucht. Der Rogen wurde unmittelbar nach der Befruchtung aus der Maulhöhle der Weibchens abgesaugt. Für den Versuch wurden 4 Gruppen aus jeweils 40 Fischeiern in jeweils einen Bruttank in einer Brutanlage gegeben. Die Gruppen 1 bis 3 wurden Konzentrationen von 1%, 5% und 10% HS ausgesetzt. Die Kontrollgruppe C hatte keinen Kontakt mit HS. In allen Gruppen wurde folgendes 30 Tage lang erfasst, bis die Fischlarven ihren Dottersack vollständig resorbiert hatten: Sterblichkeit und Größenunterschiede bei den Larven, Temperatur, der pH-Wert, Wasserhärte sowie der Nitrit- und der Nitratgehalt im Aquarienwasser. Die Ergebnisse dieser Studie legen nahe, dass HS in Konzentrationen von 5% und 10% den Nitrit- und Nitratgehalt im Wasser senken können, was einen deutlich positiven Einfluss auf die Sterblichkeit von Rogen und Fischlarven hatte. Die Bestimmung der morphologischen Größe der Larven ergab am Ende der Untersuchung im Vergleich zur Kontrollgruppe eine größere Körperlänge bei den Gruppen, die HS-Konzentrationen von 5% und 10% ausgesetzt waren. Zudem konnten wir feststellen, dass die Resorption des Dottersacks in diesen Gruppe zwei Tage früher erfolgte als in der Kontrollgruppe. Die Ergebnisse zeigen daher, dass HSn sich zum Einsatz in der künstlichen Aquarienaufzucht von Laich und Fischlarven eignen, die zunehmend widrigen Umweltfaktoren unterliegt. Das Wissen, das wir mit dieser Studie erlangten, und der Wissenstransfer in die aquaristische Praxis erlaubt selbst weniger erfahrenen Aquarianern, Fische erfolgreich in ihren Becken zu züchten, die ohne Zugabe von HS normalerweise in künstlichen Bedingungen als nicht züchtbar gelten.
Schlüsselwörter: Aquarium; afrikanische Cichliden; künstliche Aufzucht; Fischlarven; Wachstum; Huminsäuren
1. Einführung
Die Aquaristik ist im Moment eines der beliebtesten Hobbys. Die Zahl der Aquarianer steigt, ebenso wie das Wissen um die Fischzucht und die Kultivierung von Aquarienpflanzen. Was vor einigen Jahren selbst für erfahrene Aquarianer als schwierig galt, kann heute ein Einsteiger viel schneller und mit besseren Erfolgen erzielen. Bei manchen Themen gibt es jedoch immer noch Probleme; so fehlen Informationen, was bei bestimmten Krankheiten zu tun wäre, oder bei der Befruchtung und Aufzucht des Laichs und der Fischlarven verschiedener Aquarienfische. Das Hauptproblem besteht in der Anwesenheit von Schadstoffen im Aquarienwasser, die akute Vergiftungen hervorrufen können. Ein weiterer häufiger Faktor für einen Misserfolg ist die Verpilzung von Laich oder Fischlarven, was an physikalischen und chemischen Veränderungen des Wassers liegt, die die Vermehrung von schädlichen Keimen fördern [1,2].
Eine Möglichkeit, diesen unerwünschten Veränderungen und den dadurch verursachten Verlusten bei der Fischzucht vorzubeugen, ist eine Wasserbehandlung mit verschiedenen Tonmineralien wie Smektit, Bentonit, Leonardit und Alginit. Viele dieser Mineralien können die Mikroumgebung entgiften, und manche davon sind reich an Humaten, die für die aquatische Fauna und Flora eine wichtige Rolle spielen [3,4].
Hauptsächlich das Tonmineral Alginit scheint vielversprechend für eine flächige Verwendung, weil es besonders viele Huminstoffe enthält. Das Nichteisenerz Alginite ist ein Rohstoff, der bei der Versteinerung von Ansammlungen organischen (Algen) und anorganischen Materials (insbesondere Ton - Montmorillonit, Illit, Smektit -, Karbonaten - Dolomit, Kalzit, Aragonit -, Quarz und amorphen Ausfällungen von Kieselsäure in wässrigen Umgebungen) entsteht. Das organogene Sediment wird mit Ölschiefer in Zusammenhang gebracht und entsteht durch die Aktivität einer Gruppe primitiver gelbgrüner Algen (Botryococcus braunii). Die Huminstoffe in Alginit bestehen aus einer Mischung aus verschiedenen wasserunlöslichen Komponenten: Huminsäuren, die sich in alkalischen Flüssigkeiten lösen; Fulvosäuren, die sich in sauren Flüssigkeiten lösen; Hymatomelansäuren, die sich in Alkohol und in Acetylbromid lösen.
Die Fulvosäuren (braune Huminsäuren) und Huminsäuren (schwarze Huminsäuren) unterscheiden sich durch ihre Molekularstrukturen und ihre Bindung an den Boden [5].
Die Verwendung von Huminsäuren (HS) im Aquarium steckt noch in den Kinderschuhen, auch wenn erfahrene Aquarianer sie verwenden. Häufig ist den Verwendern nicht bekannt, wie sie die physikalischen und chemischen Eigenschaften des Wassers verändern und die Gesundheit und das Immunsystem der Fische beeinflussen. Daher wurden vor einigen Jahren Forschungsprojekte gestartet, mit denen mehr über positive oder negative Effekte von Huminstoffen und ihre Verwendung im Aquarium zur Vorbeugung von Schadwirkungen und Krankheitsprävention und -behandlung herausgefunden werden sollte [6-8].
Die Ergebnisse der relevanten Untersuchungen deuten auf eine ganze Palette nützlicher Eigenschaften der Huminstoffe hin, wie beispielsweise eine Intensivierung der unspezifischen Immunantwort, eine höhere Fertilität, und sogar das Überleben von Fischen in Bedingungen, in denen sie ohne die Zugabe von Huminstoffen eigentlich sterben würden. Die bisher verfügbare Forschung beschäftigte sich jedoch nur mit ausgewachsenen Fischen, nicht mit Laich oder Fischlarven [9-12]. Für fortgeschrittene Aquarianer, die Fische nicht nur zum Spaß züchten, sondern sich der Vermehrung verschiedener Arten widmen, die unterschiedliche Bedürfnisse haben, sind sie daher nur von eingeschränkter Bedeutung. Für eine effiziente Zucht und Vermehrung wurden verschiedene künstliche Methoden entwickelt, die teils sehr komplexe Mechanismen und verschiedene Faktoren beinhalten, die Einfluss auf das Biotop im Aquarium haben [13] und für die verschiedene natürliche Substanzen einschließlich HS zum Einsatz kommen [6].
Das Ziel der Studie ist, den Effekt von HS in verschiedenen Konzentrationen auf die Mortalitätsrate und quantitative Wachstumsparameter (Körperlänge, Resorption des Dottersacks) während der Inkubation des Laichs und der Entwicklung der Fischlarven zu vergleichen. Hierfür wurde eine ausgewählte Zierfischart aus der Familie der Buntbarsche (Labidochromis caerelus) verwendet. Auch sollten die Auswirkungen der Huminstoffe auf die Stabilisierung physikochemischer Eigenschaften des Wassers (Temperatur, pH-Wert, Härte, Nitrit und Nitrat) gemessen werden, die überlebensnotwendig für die Fische und für eine erfolgreiche künstliche Aufzucht sind.
2. Materialien und Methode
2.1. Die Cichliden, Umweltbedingungen und Vermehrung
Die verwendeten Buntbarsche gehören zu den am wenigsten anspruchsvollen Arten. Ausgewachsen sind sie 8-13 cm groß. Labidochormis caeruleus gehört zu den Maulbrütern mit intensiver Brutpflege. In der Natur laicht das Weibchen auf einem flachen Stein ab und nimmt die Eier sofort mit dem Maul auf. Die Männchen dieser Cichlidengattung haben Laichflecken auf ihrer Afterflosse. Wenn das Weibchen den Laich aufnimmt, zittert das Männchen mit seiner Afterflosse und zeigt seine auffälligen Laichflecken. Das Weibchen pickt instinktiv danach, und in diesem Moment entlässt das Männchen sein Sperma direkt ins Maul seiner Partnerin. So wird der aufgenommene Laich effektiv befruchtet. Das Weibchen behält den Laich in seiner Maulhöhle in einer speziellen Laichtasche, der Wangentasche. Hier bleiben die Eier, bis die Larven schlüpfen. Das ist in der Regel nach 21 bis 36 Tagen der Fall. Während der ganzen Zeit frisst das Weibchen nicht. Auch nach dem Schlupf kümmert sich das Weibchen noch um seinen Nachwuchs und nimmt die Kleinen beispielsweise bei drohender Gefahr wieder in seine Maulhöhle [14].
2.2. Aufbau des Versuchs und künstliche Aufzucht
Das Experiment wurde von der Ethikkommission der Universität für Veterinärsmedizin und Pharmazie von Košice genehmigt (Protokollcode EKV/2022-11). Acht zweijährige adulte Weibchen und vier Männchen der afrikanischen Cichlidenart Labidochormis caeruleus in der Größe von 11 bis 13 cm kamen in der Studie zum Einsatz. Die Fische wurden in 240-Liter-Aquarien gehalten. Je vier Weibchen und zwei Männchen lebten in einem Becken. Die Wassertemperatur betrug 24 °C, mit einer Gesamthärte von > 15 °dGH und einem pH-Wert von 8,0, Sie wurden zweimal täglich mit dem Hauptfutter Sera flora (Heinsberg, Deutschland) gefüttert, und jeden vierten Tag wurde ein 25%-iger Wasserwechsel in beiden Aquarien durchgeführt (Bild 1).

Bild 1: Aquarium mit den Zuchttieren von Labidochormis caeruleus, und die Wangentasche eines Weibchens, in der der Laich aufbewahrt wird.
Um neue Methoden der Laichbefruchtung und Larvenaufzucht einzuführen, wurden die Weibchen mit Laich in der Wangentasche aus dem Aquarium herausgefangen, und der Laich wurde mit einer speziellen Entnahmemethode möglichst frühzeitig aus ihrem Maul entnommen. Dabei wurde die Wangentasche mehrfach mit Hilfe einer wassergefüllten Spritze über einer Schüssel mit Aquarienwasser ausgespült. Nach der letzten Spülung befand sich kein Laich mehr in der Wangentasche.
Danach wurde der Laich mittels eines Filterschlauchs in ein Brutgerät mit künstlicher Aufzuchtkammer überführt; eine Pumpe sorgt für eine beständige leichte Wasserströmung und hält die Laichkörnchen in Bewegung.
Das Brutgerät dient als Ersatz für die mütterliche Wangentasche. So konnten wir sicherstellen, dass der Laich nicht versehentlich ausgespuckt oder abgeschluckt wurde, wenn der Mutterfisch Stress hatte. Die ausgewaschenen Laichkörner wurden wahllos zum Ausbrüten und zur Larvenaufzucht in 4 Gruppen à 40 Eier aufgeteilt. Jede Gruppe wurde in zwei identische Untergruppen aufgeteilt, mit jeweils 20 Eiern. Danach wurde der Laich jeweils mit 1%-iger, 5%-iger und 10%-iger Lösung von Huminsäuren versetzt. Das Wasser der Kontrollgruppe wurde nicht mit Huminsäuren versetzt.
Nach 5-7 Tagen schlüpften aus dem Laich die Fischlarven. Sie wurden aus dem Brutapparat in Aquarien mit jeweils 10 Litern Wasser und den entsprechenden HS-Konzentrationen überführt. Die Becken waren mit einem Sprudelstein ausgerüstet und wurden extern auf die Zieltemperatur von 26 °C aufgeheizt. Dazu stand hinter dem jeweiligen Aquarium mit den Larven ein Wasserbehälter, der 2 °C wärmer war. Nach 30 Tagen wurden die Larven aller Gruppen schonend durch gesättigtes Salzwasser getötet und mit Formalin fixiert, wie bei Wang et al. [15] beschrieben, damit in der Folge ihre physiologischen Parameter gemessen werden konnten (siehe Bild 2).
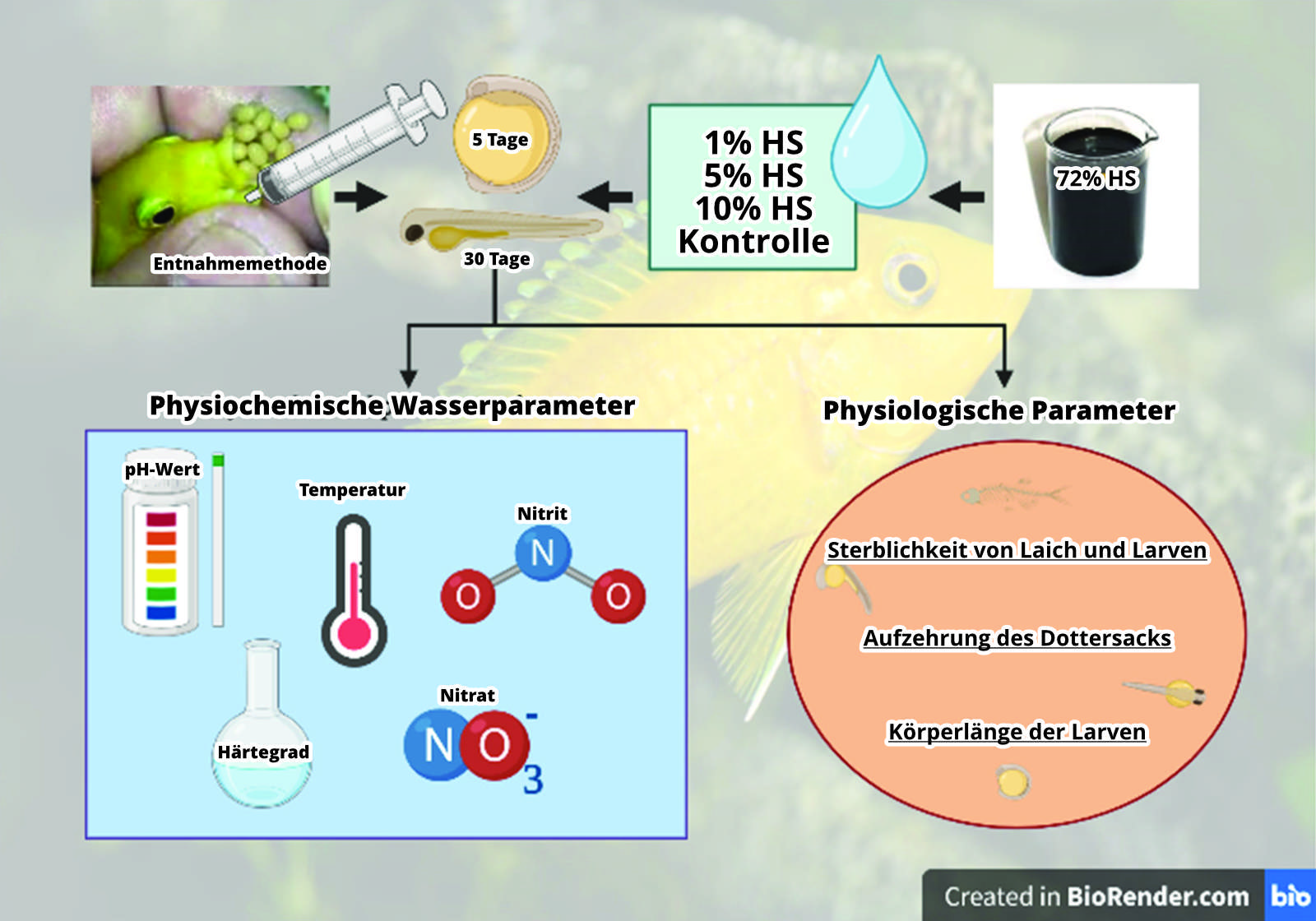
Bild 2: Schema der Versuchsaufstellung
2.3. Zubereitung des Alginit-Konzentrates mit HS
Vorgetrocknetes gemahlemes Alginit (Algivo, s.r.o., Lučenec, Slowakei) der Körnung 1-1,3 mm, mit Gammastrahlung bestrahlt (Bioster, Veverská Bitýška, Tschechien) wurde als fossiler Zusatzstoff für die Zubereitung des Konzentrats verwendet. Gemäß der Methode von Barančikova und Litavec [16] wurde die alkalische Lösung (pH = 13) Na4P2O7 verwendet, um die Huminstoffe aus dem Alginit zu extrahieren. Mit Calcium- und Sesquioxid-Humaten bildet die Verbindung hydrolysierte Ca- und Fe-Diphosphate, wasserunlöslich, aber in einem Überschuss Diphosphat löslich, bei gleichzeitiger Bildung komplexer Salze. Danach wurde die Bestimmung des Anteils von 72% Huminsäuren im zubereiteten Sickerwasser vom Forschungsinstitut für Bodenwissenschaften und Naturschutz (Prešov, Slowakei) gemäß der Barančiková-Methode vorgenommen [17].
2.4. Laboranalyse
Die Körperlänge der in Formalin fixierten Cichlidenlarven aller vier Gruppen (jeweils 12 pro Gruppe) wurden von der Abteilung für Morphologische Disziplinen der Universität für Veterinärsmedizin und Pharmazie in Košice in histologischen Schnitten vermessen. Die Körperlänge von den Kiemen bis zum Schwanzansatz wurde auf einem Mikrotom (Laika histoslide 2000) mit dem Bildprogramm J 1,45j gemessen. Inwieweit die im Versuch verwendeten Larven ihren Dottersack aufgezehrt hatten, wurde während der letzten 8 Tage des Experiments durch Sichtkontrolle erhoben, jeweils an Tag 22, 24, 26, 28 und 30, Der Dottersack wurde als aufgezehrt angenommen, wenn seine Kontur mit der Bauchlinie der Larven übereinstimmte und die Fische selbstständig aktiv zu fressen begannen.
Die physikalischen und chemischen Wasserparameter wurden während des 30 Tage währenden Versuchs alle fünf Tage überprüft. Die Wassertemperatur wurde mit einem Quecksilber-Thermometer (Sera, Heinsberg, DE) überwacht. Der pH-Wert, die Gesamthärte (°dGH), Nitrit und Nitrat wurde mit Sera Stäbchentests (Heinsberg, DE) nach der Methode von Riffel et al. bestimmt [3].
2.5. Statistische Analyse
Die gemessenen Körperlängen, die Aufzehrung des Dottersacks und die physikochemischen Wasserparameter wurden gemäß der ANOVA-Varianzanalyse evaluiert, mit Signifikanzniveau ⍺ = 0,05. Die Kontrollgruppe wurde mit den Gruppen verglichen, die in verschiedenen HS-Konzentrationen gehalten wurden.
3. Ergebnisse und Diskussion
Die Ergebnisse der Studie zeigen einen positiven Effekt durch die Zugabe von HS bei allen drei Gruppen. Die Schlupfrate der Laichkörnchen stieg, und die Larven entwickelten sich während der 30-tägigen Überwachungszeit im Aufzuchtbehälter. Zu Beginn der Studie (an Tag 1) wurden pro Gruppe 40 Laichkörner angesetzt. An Tag 5 (nach dem Schlupf) wurde in der Kontrollgruppe die höchste Mortalität festgestellt (30%). An diesem Tag erreichte die Mortalität in der Gruppe mit 1% HS 17,5%, während in den Gruppen mit 5% und 10% HS die festgestellte Mortalität bei 5% lag. Am Ende der Beobachtungszeit (30 Tage), wurde die höchste Mortalität (40%) wiederum in der Kontrollgruppe gefunden. In der Gruppe mit 1% HS lag die erfasste Mortalität bei 20,0%; in den Gruppen mit 5% und 10% HS lag die Mortalität bei 7,5% respektive bei 10,0%. Gemäß der ANOVA-Varianzanalyse mit Signifikanzlevel = 0,05 zeigt sich, dass die Konzentrationen von 5% und 10% von Huminsäuren einen statistisch relevanten Effekt auf die Überlebensrate der Cichliden während der Beobachtungszeit hatten (Tabelle 1).
Das Ergebnis unserer Studie deutet auf einen vergleichbaren Effekt zu Meinelt et al. [18] hin, die Huminstoffe (HS) hinsichtlich der Giftigkeit von Acriflavin für Embryos und Larven des Zebrabärblings Danio rerio untersuchten. Die Autoren modellierten die Umgebung für die Larven unter Zugabe von Acriflavin. In den Kontrollgruppen ohne Zugabe von HS, wurde eine im Vergleich zu den Gruppen mit Zugabe verschiedener Konzentrationen von HS höhere Mortalität festgestellt.
Ein statistisch relevanter Effekt auf die Reduzierung der Mortalität wurde auch von Abdel-Wahab et al. [19] festgestellt, die dem Futter für Karpfen (Cyprinus carpio) für 45 Tage 0,4%, 0,8% und 1% Huminsäuren zugaben. Am Ende der Beobachtungszeit setzten die Autoren alle Fische 5 Tage lang einer Dosis von 1,75 mg/l Stickstoffmonoxid aus. In den Gruppen mit 0,8% und 1% Huminsäuren im Futter lag die festgestellte Mortalität 50% to 70% unter der in der Kontrollgruppe, die nicht mit Huminsäuren gefüttert worden war.
Tabelle 1: Mortalität von Laich und Larven in den Versuchsgruppen während der Beobachtungszeit von 30 Tagen.
| Tag/Gruppe | 1% HS | 5% HS | 10% HS | Kontrolle |
| lebend/tot (n) | lebend/tot (n) | lebend/tot (n) | lebend/tot (n) | |
| Laich am 1. Tag | 40/0 | 40/0 | 40/0 | 40/0 |
| Laich am 5. Tag | 33/7 | 38/2 | 38/2 | 28/12 |
| Larven am 10. Tag | 33/7 | 38/2 | 38/2 | 26/14 |
| Larven am 20. Tag | 33/7 | 38/2 | 36/4 | 26/14 |
| Larven am 30. Tag | 32/8 | 37/3 | 36/4 | 24/16 |
| p-Wert | 0,13 | 0,012 * | 0,017 * | - |
| Anmerkung: 1%, 5%, 10% HS bezeichnet die Gruppen, die verschiedenen Konzentrationen von HS (Huminsäure) ausgesetzt waren, die aus Alginat extrahiert wurden; n bezeichnet die Zahl der Laichkörner oder Larven in jeder Testgruppe. Der p-Wert * basiert auf der ANOVA-Varianzanalyse mit Signifikanzniveau ⍺ = 0,05. Die Kontrollgruppe wurde mit den Gruppen verglichen, die verschiedenen Konzentrationen von HS ausgesetzt waren. | ||||
Ein weiteres Anzeichen für den positiven Effekt einer HS-Zugabe war die durchschnittliche Körperlänge der Larven. Die Ergebnisse zeigen am Ende der 30-tägigen Beobachtungszeit größere Larvallängen in den Gruppen, die einer Konzentration von 5% und 10% Huminsäuren ausgesetzt waren (Bild 3). Die größere Körperlänge der Larven in den betreffenden Gruppen waren vermutlich stärkerem Wachstum geschuldet. Der Dottersack wurde in allen Gruppen, die Konzentrationen von 1%, 5% und 10% HS ausgesetzt waren, schneller resorbiert als in der Kontrollgruppe (Tabelle 2). Die statistische Analyse ergab im Vergleich zur Kontrollgruppe eine größere Anzahl von Larven mit aufgezehrten Dottersäcken nach 26 und 28 Tagen in allen Gruppen, die HS ausgesetzt waren.
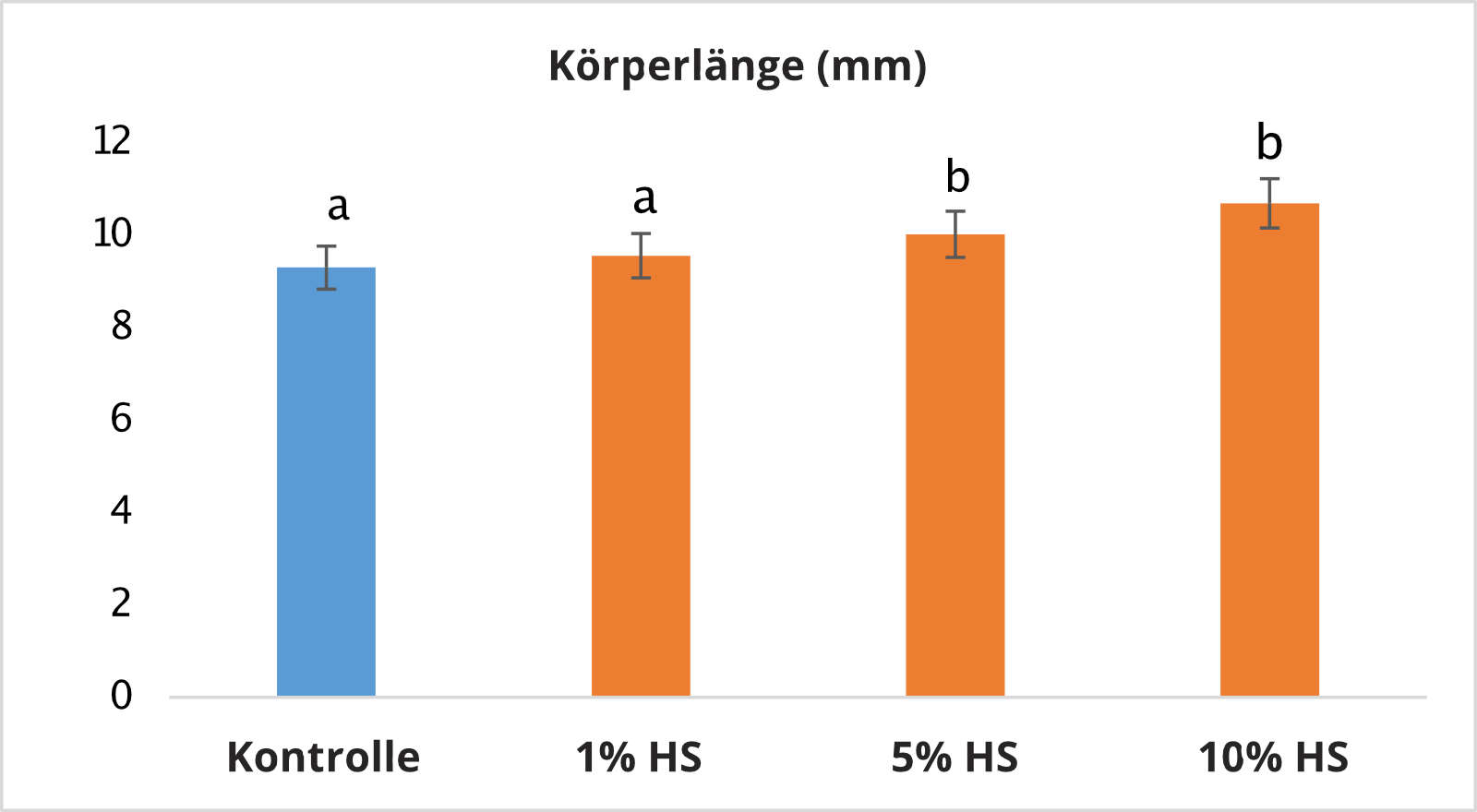
Bild 3: Vergleich der Körperlänge der Larven am Ende der 30-tägigen Beobachtungszeit. Anmerkung: a, b - Werte oberhalb der Säule mit verschiedenen Buchstaben zeigten eine relevante Abweichung bei p < 0,05.
Tabelle 2: Vergleich der Aufzehrung des Dottersacks während der künstlichen Aufzucht.
| Tag/Gruppe | 1% HS | 5% HS | 10% HS | Kontrolle |
| n/% | n/% | n/% | n/% | |
| Larven am 22. Tag | 0/0 | 0/0 | 0/0 | 0/0 |
| Larven am 24. Tag | 0/0 | 6/15,8 | 11/30,5 | 0/0 |
| Larven am 26. Tag | 14/42,4 | 28/75,7 | 26/72,2 | 7/26,9 |
| Larven am 28. Tag | 23/71,8 | 34/91,9 | 33/91,7 | 12/50,0 |
| Larven am 30. Tag | 32/100,0 | 37/100,0 | 36/100,0 | 24/100,0 |
| p-Wert | 0,037 * | 0,021 * | 0,028 * | - |
| Anmerkung: 1%, 5%, 10% HS bezeichnet die Gruppen, die verschiedenen Konzentrationen von HS (Huminsäure) ausgesetzt waren, die aus Alginat extrahiert wurden; n bezeichnet die Zahl der Larven mit resorbiertem Dottersack in jeder Testgruppe. Der p-Wert * basiert auf der ANOVA-Varianzanalyse mit Signifikanzniveau ⍺ = 0,05. Die Kontrollgruppe wurde mit den Gruppen verglichen, die verschiedenen Konzentrationen von HS ausgesetzt waren. | ||||
Tabelle 3 (unten) zeigt die physikalischen (Temperatur) und chemischen (pH, Nitrit- und Nitratwerte sowie die Wasserhärte) Wasserparameter. Die chemischen Eigenschaften des Wassers unterlagen offensichtlichen Veränderungen, insbesondere wurde die Differenz zwischen der Kontrollgruppe und den Gruppen mit einer Konzentration von 5% und 10% HS deutlich. Die Zugabe von HS beeinflusste die Wasserhärte, insbesondere bei den Gruppen mit einer Konzentration von 5% und 10%, was sich positiv bei der Haltung von Fischen aus Weichwasserhabitaten oder beim künstlichen Ausbrüten und der Aufzucht von Fischlarven auswirken kann, was bei uns der Fall war. Mungkung et al. [20] bestätigen in ihrer Studie, dass die Zugabe von 0,5, 5,0 und 50,0 mg/l Huminsäure die Gesamthärte in weichem, mittelhartem und hartem Wasser senkte. Zusätzlich zeigten die Huminstoffe einen positiven Einfluss auf die Überlebensrate von Puntius gonionotus bei Zugabe von Kadmium während der Beobachtungszeit.
Ein weiterer Wasserwert, der sich deutlich veränderte, war der pH-Wert. Die Ergebnisse zeigen eine pH-Senkung vor allem in den Gruppen mit einer Konzentration von 5% und 10% HS, was sich positiv in der niedrigeren Mortalität der Larven und weniger verpilzten Eiern zeigte. Insbesondere Wasserschimmel überleben diese Bedingungen nicht.
Perminova et al. [9] konnten nachweisen, dass HS die Funktion des Immunsystems und das Wachstum bei Fischen beeinflussen, Schwermetalle und organische Schadstoffe binden, das Wachstum von Cyanobakterien hemmen, die Strahlungsfunktion regulieren und die Fische vor negativen Folgen von Umweltstress schützen. In Wasser mit natürlichem Huminsäuregehalt gibt es weniger Schwankungen bei Sauerstoffgehalt und pH-Wert, was einen positiven Effekt auf die Anpassungsfähigkeit der Fische hat und die Mortalität während extremen Wetterwechseln reduzieren kann. In ihrer Studie konnten die Autoren auch nachweisen, dass HS fungizide, antiparasitische und antibakterielle Eigenschaften haben und das Wachstum von Aeromonas hydrophila, A. sobria, Edwardsiella iclaluri, E. tarda, Pseudomonas fluorescens und Escherichia coli hemmen.
In der Natur liegen die pH-Werte für Malawi-Cichliden bei 7,7 bis 8,6 und für Tanganjika-Cichliden bei 7,3 bis 8,0. Die Wasserhärte im Malawisee liegt Berichten zufolge bei 6 bis 10 Härtegraden (DH) und im Tanganjikasee bei 10 bis 12 °DH [14]. Erfahrungen haben gezeigt, dass sich Tanganjika- und Malawicichliden bei einem so niedrigen pH-Wert wie 7,2 und einer Wasserhärte von nur 3 °DH [21] wohlfühlen und sogar vermehren, was wir mit unserer Studie bestätigen konnten. Die Stabilität der Wasserwerte scheint wichtiger zu sein als die absolute Wasserhärte. Die Ergebnisse unserer Studie zeigen, dass Konzentrationen von 5% und 10% Huminsäure den pH-Wert und die Wasserhärte während der Beobachtungszeit effektiv stabilisierten.
Tabelle 3: Vergleich der physikochemischen Eigenschaften des Wassers.
| Parameter/Gruppe | 1% HS | 5% HS | 10% HS | Kontrolle |
| Temperature (°C) | 26 +/- 1 | 26 +/- 1 | 26 +/- 1 | 26 +/- 1 |
| Wasserhärte (°dGH) | 15 +/- 2,0 a | 10 +/- 3,0 b | 7 +/- 3,0 b | 16 +/- 2,0 a |
| pH-Wert | 8,0 +/- 0,5 a | 7,5 +/- 0,5 b | 7,2 +/- 0,6 b | 8,5 +/- 0,5 a |
| Nitrit (mg NO2/l) | 1,0 +/- 0,4 b | 0,1 +/- 0,05 b | 0,1 +/- 0,05 b | 5,0 +/- 0,9 a |
| Nitrat (mg NO3/l) | 30 +/- 5,5 b | 20 +/- 2,0 b | 10 +/- 1,5 b | 100 +/- 20,0 a |
| Anmerkung: 1%, 5%, 10% HS bezeichnet die Gruppen, die verschiedenen Konzentrationen von HS (Huminsäure) ausgesetzt waren, die aus Alginat extrahiert wurden;. a, b - Werte mit unterschiedlichen Buchstaben in den Reihen unterschieden sich signifikant bei p < 0,05. | ||||
Einer der wichtigsten Parameter für das Wohlergehen von Aquarienfischen ist der Nitritgehalt des Wassers. Für Fischlarven und Jungfische gilt eine Nitritkonzentration von bis 0,1 mg/l als ungefährlich. Höhere Konzentrationen dagegen bergen das Risiko einer akuten Vergiftung und eines plötzlichen Todes für die Larven [2]. Aus den Veränderungen des Nitritwertes bei den Testgruppen ließ sich schließen, dass schon in einer 1%-igen Konzentration die Huminsäure das Nitrit im Wasser binden konnte und so einen wichtigen Beitrag zu einer erfolgreichen Aufzucht der Fischlarven und für die Stabilität der Bedingungen im Aquarium leistete.
Der letzte relevante Parameter ist die Nitratkonzentration - zwar nicht ganz so bedeutsam wie Nitrit, aber doch ein wichtiger Indikator bei der Beurteilung der Wasserqualität. [1]. Die Ergebnisse unserer Studie deuten darauf hin, dass die Zugabe von HS noch einen weiteren positiven Effekt hat, nämlich seine Fähigkeit, die Nitratkonzentration im Wasser zu verringern. Der optimale empfohlene Nitratwert liegt bei 10 - 30 mg/l. Nitrate sind für Fische nicht so schädlich wie Nitrite; daher rufen auch noch höhere Konzentrationen von 30-50 mg/l noch keine Vergiftungserscheinungen hervor [2]. Bei sehr hohen Konzentrationen (über 50 mg/l) können sie eine akute Vergiftung hervorrufen, ähnlich wie Nitrite. Auch das konnten wir in unserer Studie bestätigen: Die hohe Nitratkonzentration im Wasser unserer Kontrollgruppe (100 mg/l) trug sehr wahrscheinlich zu einem großen Teil zur 40%-igen Mortalitätsrate dieser Fischlarven bei.
4. Fazit
Die Ergebnisse dieser Studie zeigten einen deutlichen Erfolg bei der künstlichen Aufzucht afrikanischer Cichliden (Labidochormis caeruleus), wenn ein geeignetes Umfeld während des künstlichen Ausbrütens des Laichs und bei der Larvenaufzucht geschaffen wurde, indem verschiedene Konzentrationen von HS zugegeben wurde. Am stabilsten erwies sich das Aquarienwasser der Gruppen, die Konzentrationen von 5% und 10% HS ausgesetzt waren, was sich in deutlich reduzierten Nitrit- und Nitratgehalten äußerte und zu einer stark verminderten Mortalität bei Laich und Fischlarven führte. Dieses Wissen lässt sich bei der Vorbeugung akuter Vergiftungen bei der Aufzucht von Laich und Fischlarven im Aquarium nutzen. Zusätzlich nahmen als Folge der Zugabe von HS der pH-Wert und die Wasserhärte im Verhältnis zur HS-Konzentration ab. Obwohl im Malawisee endemische Cichliden pH-Werte von 7,7 bis 8,6 bevorzugen, lassen sich ihre Larven bei pH-Werten von 7,2 bis 7,5 und einer Gesamthärte von 7 bis 10 erfolgreich aufziehen. Wenn der pH-Wert des Wassers alkalisch wird, steigt das Risiko einer Laichverpilzung; der Einsatz von HS kann daher dieses Risiko minimieren und den pH-Wert auf einem Niveau stabilisieren, auf dem es noch keine Verluste gibt. Als kritisch sehen wir eher die Stabilität der Werte an und nicht so sehr die absoluten Werte selbst. Die Ergebnisse unserer Studie zeigten, dass die Zugabe von Huminsäure bis zu einer Konzentration von 5% und 10% den pH-Wert und die Wasserhärte während der Beobachtungszeit effektiv stabilisierten.
Zusätzlich zur Stabilisierung der physikochemischen Wasserparameter konnten wir Größenunterschiede bei den Gruppen feststellen, die einer Konzentration von to 5% und 10% HS ausgesetzt waren. Die Larven dieser Gruppen waren am Ende des Beobachtungszeitraums im Vergleich zur Kontrollgruppe deutlich größer, was den positiven Einfluss der HS auf diese Organismen vom physiologischen Standpunkt aus und hinsichtlich der zügigen Aufzehrung des Dottersacks und des damit zusammenhängenden Wachstums untermauert. Ein relevanter Unterschied ließ sich an den Tagen 26-28 des Beobachtungszeitraums bei den Larven in den Gruppen mit einer Konzentration von 5%
und 10% HS beobachten; hier war der Dottersack zu 90% aufgebraucht, während er in der Kontrollgruppe lediglich auf 50% geschrumpft war.
Das Wissen, das wir im Rahmen dieser Studie erworben haben und sein Transfer in die aquaristische Praxis kann selbst wenig erfahrenen Aquarianern helfen, Aquarienfische zu züchten, die normalerweise ohne die Zugabe von HS in künstlichen Aufzuchtbedingungen nicht nachzuzüchten sind.
Literaturangaben
1. Werkman, P.J. De vissenkom en de waterkwaliteit. The aquarium und the water quality Part 3. Tijdschr. Diergeneeskd. 2007, 1, 524-528.
2. Roberts, H.; Palmeiro, B.S. Toxicology of aquarium fish. Vet. Clin. N. Am. Exot. Anim. Pract. 2008, 11, 359-374.
3. Riffel, A.P.; Saccol, E.M.; Finamor, I.A.; Ourique, G.M.; Gressler, L.T.; Parodi, T.V.; Goulart, L.O.; Llesuy, S.F.; Baldisserotto, B.; Pavanato, M.A. Humic acid und moderate hypoxia alter oxidative und physiological parameters in different tissues of silver catfish (Rhamdia quelen). J. Comp. Physiol. B 2014, 184, 469-482.
4. Meinelt, T.; Schreckenbach, K.; Pietrock, M.; Heidrich, S.; Steinberg, C.E. Humic substances. In Part 2: Interactions with Organisms; Zleibniz Institute of Freshwater Ecology und Inland Fisheries: Müggelseedamm, Germany, 2004; Volume 15, pp. 128-135.
5. Gancarčíková, S.; Nemcová, R.; Popper, M.; Hrčková, G.; Sciranková, L’.; Mad’ar, M.; Mudroňová, D.; Vilček, Š.; Žitňan, R. The Influence of Feed-Supplementation with Probiotic Strain Lactobacillus reuteri CCM 8617 und Alginite on Intestinal Microenvironment of SPF Mice Infected with Salmonella Typhimurium CCM 7205. Probiotics Antimicrob. Proteins 2019, 11, 493-508.
6. Meinelt, T.; Schreckenbach, K.; Pietrock, M.; Heidrich, S.; Steinberg, C.E. Humic substances. Part 1: Dissolved humic substances (HS) in aquaculture und ornamental fish breeding. Environ. Sci. Pollut. Res. Int. 2008, 15, 17-22.
7. Dutton, J.; Fisher, N.S. Influence of humic acid on the uptake of aqueous metals by the killifish Fundulus heteroclitus. Environ. Toxicol. Chem. 2012, 31, 2225-2232.
8. Lee, J.G.; Yoon, H.Y.; Cha, J.Y.; Kim, W.Y.; Kim, P.J.; Jeon, J.R. Artificial humification of lignin architecture: Top-down and bottom-up approaches. Biotechnol. Adv. 2019, 37, 107416.
9. Perminova, I.V.; Hatfield, K.; Hertkorn, N. Use of Humic Substances to Remediate Polluted Environments: From Theory to Practice. In Proceedings of the NATO Advanced Research Workshop on Use of Humates to Remediate Polluted Environments, Zvenigorod, Russia, 23-29 September 2002. Life 2023, 13, 1071 9 of 9
10. Yamin, G.; Falk, R.; Avtalion, R.R.; Shoshana, N.; Ofek, T.; Smirnov, R.; Rubenstein, G.; van Rijn, J. The protective effect of humic-rich substances on atypical Aeromonas salmonicida subsp. salmonicida infection in common carp (Cyprinus carpio L.). J. Fish Dis. 2017, 40, 1783-1790.
11. Wang, X.; Liu, L.; Liang, D.; Chen, S.; Fan,W. Influence of Humic Acid on Oxidative Stress Induced by Arsenite und Arsenate Waterborne Exposure in Danio rerio. Bull Environ. Contam. Toxicol. 2021, 106, 786-791.
12. Prokešová, M.; Bušová, M.; Zare, M.; Tran, H.Q.; Kučerová, E.; Ivanova, A.P.; Gebauer, T.; Stejskal, V. Effect of Humic Substances as Feed Additive on the Growth Performance, Antioxidant Status, und Health Condition of African Catfish (Clarias gariepinus, Burchell 1822). Animals 2021, 11, 2266.
13. Xu, K.; Duan, W.; Xiao, J.; Tao, M.; Zhang, C.; Liu, Y.; Liu, S. Development und application of biological technologies in fish genetic breeding. Sci. China Life Sci. 2015, 58, 187-201.
14. Santos, M.E.; Lopes, J.F.; Kratochwil, C.F. East African cichlid fishes. Evodevo 2023, 14, 1.
15. Wang, Y.N.; Lee, K.; Pai, S.; Ledoux,W.R. Histomorphometric comparison after fixation with formaldehyde or glyoxal. Biotech. Histochem. 2011, 86, 359-365.
16. Barančíková, G.; Litavec, T. Comparison of chemischen structure of alginite Huminsäuren isolated with two different procedures with soil Huminsäuren. Agriculture 2016, 62, 138-148.
17. Barančíková, G. Monitoring kvantitatívneho a kvalitatívneho zloženia pôdnej organickej hmoty. In Monitoring of the Quantitative and Qualitative Composition of Soil Organic Matter (Slovak); Kobza, J., Barančíková, G., Hrivňáková, K., Makovníková, J., Pálka, B., Styk, J., Eds.; Výskumný Ústav Pôdoznalectva a Ochrany Pôdy: Bratislava, Slowakei, 2010; 251p, ISBN 978-80-8163-004-0, Available online: https://www.vupop.sk/dokumenty/rozne_monitoring_pod_slovenska.pdf (accessed on 8 April 2023).
18. Meinelt, T.; Rose, A.; Pietrock, M. Effects of calcium content und humic substances on the toxicity of acriflavine to juvenile zebrafish Danio rerio. J. Aquat. Anim. Health 2002, 14, 35-38.
19. Abdel-Wahab, A.M.; El-Refaee, A.M.; Ammar, A.A. Effects of Humic Acid as Feed Additive in Improvement of Nonspecific Immune Response und Disease Resistance in Common Carp (Cyprinus carpio). Egypt. J. Aquac. 2012, 12, 83-90, Available online: https://www.semanticscholar.org/paper/Effects-of-Humic-Acid-as-Feed-Additive-in-of-Immune-Abdel-Wahab-El-Refaee/f2360f273afe74d88d496dcf0f28739906e72b9 (accessed on 1 February 2012).
20. Mungkung, R.; Upatham, E.S.; Pokethitiyook, P.; Kruatrachue, M.; Panichajakul, C. Effects of Humic Acid andWasserhärte on Acute Toxicity und Accumulation of Cadmium in the Freshwater Fish (Puntius gonionotus Bleeker). ScienceAsia 2001, 27, 157-164.
21. Sean, B. Malawi Cichlids Water Parameters: Temperatur, pH und GH. 2020, Available online: https://theaquariumadviser.com/malawi-cichlids-water-parameters/ (accessed on 6 June 2020).
Haftungsausschluss/Herausgeber-Anmerkung: Die in allen Veröffentlichungen enthaltenen Aussagen, Meinungen und Daten stammen ausschließlich von den einzelnen Autoren und Mitwirkenden und nicht von MDPI und/oder den Herausgebern. MDPI und/oder der/die Herausgeber lehnen jede Verantwortung für Personen- oder Sachschäden ab, die sich aus Ideen, Methoden, Anweisungen oder Produkten ergeben, auf die im Inhalt Bezug genommen wird.


