- 1 - Was sind Huminstoffe?
- 1.1 - Huminstoffe im Wasser
- 2 - Wie wirken Huminstoffe?
- 2.1 - Indirekte Wirkungen
- 2.1.1 - Reduzierung des Keimdrucks
- 2.1.2 - Nährstoffverfügbarkeit
- 2.1.3 - Mileuverbesserung
- 2.1.4 - pH-Stabilisierung
- 2.1.5 - Schadstoffbindung
- 2.2 - Direkte Wirkungen
- 2.2.1 - Immunstärkung
- 2.2.2 - Heilwirkung
- 2.2.3 - Osmoregulation
- 2.2.4 - Vermehrung und Langlebigkeit
- 2.2.5 - Stressreduzierung
- 2.2.6 - Bessere Mineralstoffaufnahme
- 3 - Färbung des Wassers
- 4 - Laub und Erlenzapfen
- 5 - Huminstoffpräparat selber herstellen
- 6 - Dosierungsempfehlung
- 6.1 - Tiere aus Schwarzwasser
- 6.2 - Achtung Überdosierung
- 7 - Fazit
- 8 - Video - Interview: Prof. Dr. Chr. E. W. Steinberg
- 9 - Vortrag: Prof. Dr. Christian E. W. Steinberg
- 9.1 - Umweltstress, die übersehende ökol. Stellgröße
- 9.2 - Huminstoffe fördern Weiblichkeit
- 9.3 - Steigerung der Nachkommenzahl und Lebensdauer
- 9.4 - Nachkommenzahl und Stresstoleranz erhöhen
- 9.5 - Kreuztoleranzen sind nicht auf Wirbellose beschränkt
- 9.6 - Stresstoleranz pflanzt sich transgenerational fort
- 9.7 - Schlussbetrachtungen
- 10 - Studie: Zierfischzucht und Huminstoffe
Huminstoffe gehören zu den wichtigsten "Zutaten" in einem Aquarium. Nur mit ihnen lassen sich naturnahe Bedingungen schaffen, und sie werden von allen Tier- und Pflanzenarten im Aquarium benötigt. Gesundheit, Vermehrung und ein möglichst langes, stressfreies Leben, das wünschen wir unseren Aquarienbewohnern. In zahlreichen wissenschaftlichen Studien hat sich gezeigt, dass uns Huminstoffe dabei helfen können.
Schon wenige Tropfen Huminstoffe, wöchentlich dosiert und ohne große Farbveränderung des Wassers, reichen aus, um die zahlreichen positiven Eigenschaften zu nutzen.
1 - Was sind Huminstoffe?
Huminstoffe sind in der Natur das größte Reservoir an organischem Kohlenstoff. Sie sind z.B. in Falllaub enthalten und bleiben übrig, nachdem sich die Blätter am Boden in ersten Schritten zersetzt haben. Es sind also die Stoffe, die nach der Verrottung und Mineralisierung von Pflanzen in ihre Bestandteile wie Nitrat, Phosphat, Kalium, CO2, etc. im Boden verbleiben, wo sie langsam weiter verstoffwechselt werden.
Huminstoffe sind weltweit in jedem Ökosystem vorhanden, und ihr Anteil ist immer größer als alle lebenden Tiere, Pflanzen und Mikroorganismen zusammen. In der Natur spielen sie damit eine sehr wichtige Rolle.
1.1 - Huminstoffe im Wasser
Im Wasser befinden sich Huminstoffe als gelöste organische Kohlenstoffe, die analytische Einheit ist DOC (dissolved organic carbon). Sie entstehen nicht nur durch Reste von Wasserpflanzen, sondern werden hauptsächlich durch Einschwemmung von Bodenmaterial in Seen und Flüsse eingebracht.
Besonders in den Habitaten (Lebensräumen), aus denen unsere Fische, Garnelen, Krebse, Schnecken und Pflanzen in der Aquaristik kommen, ist der Huminstoffanteil sogar um ein vielfaches höher als alle lebenden Tiere, Pflanzen und Mikroorganismen zusammen. Diese Organismen haben sich also auf Huminstoffe im Wasser eingestellt und haben gelernt, diese zu ihrem Vorteil zu nutzen.
2 - Wie wirken Huminstoffe?
2.1 - Indirekte Wirkungen
Huminstoffe wirken sich nicht nur direkt, sondern auch indirekt auf die Wassertiere aus, die in huminstoffreichen Lebensräumen siedeln. Diese Wirkungen sind vielfältig und in der Mehrzahl auch im Aquarium ausgesprochen interessant. Man könnte sagen, Huminstoffe wirken umfassend und wie ein natürlicher Wasseraufbereiter.
2.1.1 - Reduzierung des Keimdrucks
Huminstoffe wirken antibakteriell und reduzieren die Keimbelastung, z. B. durch die häufig vorkommenden Bakteriengattungen Aeromonas und Pseudomonas. Huminstoffe wirken außerdem fungizid und beugen damit Infektionskrankheiten durch Pilzbefall vor. Das Myzelwachstum kann durch sie stark gehemmt oder sogar ganz gestoppt werden. Somit haben potentielle Angreifer für unsere Tiere kein gutes Milieu, um sich ungehemmt zu verbreiten und gefährlich zu werden.
2.1.2 - Nährstoffverfügbarkeit
Huminstoffe wirken als natürlicher Chelator für Pflanzennährstoffe und sorgen dafür, dass diese für die Pflanzen leichter zugänglich sind und länger im Wasser verfügbar bleiben. Sie haben eine hohe Kationen-Austausch-Kapazität (gute Verfügbarkeit von Kationen). Die Nährstoffaufnahme der Pflanzen wird somit verbessert. Insbesondere binden Huminstoffe Ammonium und reduzieren dadurch die Gefahr, dass giftiges Ammoniak entsteht.
2.1.3 - Mileuverbesserung
Huminstoffe sind reich an organischen sowie mineralischen Substanzen und verbessern das Milieu im Bodengrund. Die Abbauprozesse werden optimiert und die Pflanzenwurzeln können besser wachsen.
Auch der Algenwuchs wird vermindert. Teilweise spielt hier natürlich das verbesserte Pflanzenwachstum eine Rolle.
2.1.4 - pH-Stabilisierung
Huminstoffe stabilisieren den pH-Wert im Wasser. Bei einem Mangel an Karbonatpuffern übernehmen sie die Pufferfunktion des pH-Wertes. Insbesondere bei Weichwasser ist dies sehr wichtig, weil hier wenig bis keine Karbonathärte vorliegt. Huminstoffe schützen damit vor einem gefährlichem pH-Sturz.
2.1.5 - Schadstoffbindung
Huminstoffe können außerdem Schadstoffe binden und dadurch unschädlich machen. Neben Schwermetallen werden auch Pestizide physikalisch stabil gebunden und damit aus dem Verkehr gezogen.
2.2 - Direkte Wirkungen
Die wirklich spannenden Eigenschaften von Huminstoffen sind allerdings deren verschiedene direkte Wirkungen auf die Tiere. Dachte man früher, sie können vom Organismus nicht aufgenommen werden und hätten sozusagen nur als Reaktionsträger eine indirekte Wirkung, weiß man heute, dass Huminstoffe klein genug sind, um membrangängig zu sein. Sie wirken also auch direkt in den Zellen der Lebewesen und lösen in den Organismen Reaktionen aus.
2.2.1 - Immunstärkung
Huminstoffe sind sogenannte "Stressoren", die das Immunsystem reizen. Sie täuschen vor, ein gefährlicher Eindringling zu sein, ohne dass sie es wirklich sind. Durch Huminstoffe werden weiße Blutkörperchen (Blutzellen) aktiviert und das Immunsystem trainiert, sodass es für echte Gefahren bestens gewappnet ist. Pathogene und Parasiten sind überall und damit auch in unseren Aquarien zu finden. Läuft das Becken stabil und haben die Tiere ein gutes Immunsystem, stellt sich ein Gleichgewicht ein. So haben weder Bakterien noch Pilze eine Chance, zum Problem zu werden, und die Tiere bleiben gesund. Ändern sich aber Umweltbedingungen, z.B. durch ein nicht gut laufendes Aquarium, verstärkt sich der Stress, und die Immunabwehr verschlechtert sich. Dann haben Pilze, Parasiten und Bakterien leichtes Spiel, und ernsthafte Probleme können entstehen. Daher ist ein gesundes und aktives Immunsystem so wichtig.
2.2.2 - Heilwirkung
Infektionen, Verletzungen und Entzündungen heilen in Anwesenheit von Huminstoffen schneller ab. Sie lösen zelluläre Abwehrmechanismen aus und verstärken die Produktion von Stressproteinen, welche die Selbstheilungskräfte auf Touren bringen. Ferner gerben sie die Haut und leiten die Erneuerung von Membranen ein. Diese findet man auf den Schleimhäuten und besonders auch auf Wunden. Dadurch werden Eindringlinge effektiv abgewehrt. Bei Krankheiten wie Ichthyo / Weißpünktchenkrankheit, Flossenfäule, Wasserschimmel, Kiemennekrosen etc. wurden Huminstoffe bereits erfolgreich eingesetzt. Sie haben entzündungshemmende, entwässernde und / oder Blut stillende Effekte. Damit es gar nicht erst zu Problemen kommt, wird eine regelmäßige Zugabe von Huminstoffen empfohlen.
2.2.3 - Osmoregulation
Auch die Osmoseregulation wird durch Huminstoffe verbessert. In der Regel ist der Salzgehalt in Süßwassertieren höher als in deren Umgebung, und durch den osmotischen Druck strömt permanent Wasser in die Zellen. Die Tiere müssen es mit großem Energieaufwand wieder entfernen, um den Wassergehalt in den Zellen auszugleichen. Diese Energie muss entweder durch eine erhöhte Nährstoffaufnahme aufgebracht werden, oder sie wird von andern wichtigen Funktionen abgezwackt. Tiere wachsen dann z.B. langsamer oder entwickeln sich schlechter. Huminstoffe wirken auf die Kohäsion (Zusammenhangskraft) des Wassers und reduzieren den Energieaufwand für die Osmoregulation erheblich. Weniger Energieaufwand für die Osmoregulation bedeutet eine bessere Nutzung der Ressourcen für Wachstum und Entwicklung.
2.2.4 - Vermehrung und Langlebigkeit
In wissenschaftlichen Untersuchungen wurde festgestellt, dass verschiedene Wassertiere durch Huminstoffe länger leben und sich besser vermehren. Dies wurde z.B. bei Prachtgrundkärpflingen (Nothobranchius furzeri) nachgewiesen, aber auch bei Wasserflöhen und anderen wirbellosen Tieren.
Als Beispiel nennen wir die Versuche mit dem Fadenwurm Caenorhabditis elegans, welcher aufgrund seines schnellen Reproduktionszyklus gerne von der Wissenschaft verwendet wird. Den Würmern wurden gleichzeitig mehrere Nahrungsquellen mit unterschiedlichen Huminstoff-Konzentrationen und auch völlig ohne Huminstoffe zur Verfügung hingestellt. Die Würmer wählten immer die Futterquellen mit Huminstoffen in einer leichten bis mittleren Konzentration (5-20 mg/l DOC). Sie gingen also freiwillig zu einem "Stressor", wurden regelrecht von ihm angelockt, was die Wissenschaftler zunächst verwunderte. Als Ergebnis fand man aber heraus, dass diese Würmer anschließend länger lebten und sich besser vermehrten. Vermutlich liegt das an der hormonähnlichen Wirkung von Huminstoffen und der Aktivierung von bestimmten Genen.
Auch bei Zebrabärblingen (Danio rerio) zeichnete sich ab, dass schon eine geringe Huminstoffkonzetration eine positive Wirkung auf die Eientwicklung erbrachte. Beim Gelbbarsch (Perca flavescens) wurde beobachtet, dass der Schlupferfolg und das die Überlebensrate der Jungtiere besonders hoch waren, wenn der Huminstoffgehalt im Wasser anstieg.
2.2.5 - Stressreduzierung
Durch Huminstoffe werden zahlreich Stressproteine gebildet, die zu einer Modulierung der Biotransformations- und Antioxidations-Enzyme führen, welche Abwehr- und Bewältigungsmechanismen auslösen und die Tiere "entspannter" werden lassen.
Physischer wie psychischer Stress ist für unsere Aquarienbewohner allgegenwärtig. Ob nun durch uns selber, wenn wir uns vorm Aquarium bewegen und dies als potentielle Gefahr wahrgenommen wird, oder durch Aktionen, die wir im Aquarium durchführen, wie z.B. Wasserwechsel, Pflanzenschnitt, bis hin zum Keschern der Tiere.
In sehr zeitaufwändigen Untersuchungen mit jungen Schwerträgern (Xiphophorus helleri) in huminstofffreiem Wasser wurde festgestellt, dass die Fische, die regelmäßig mit dem Kescher gefangen und in ein anderes Becken gesetzt wurden, das Wachstum durch den Stress nahezu komplett einstellten. Wohingegen die Kontrollgruppen, selbst jene in den niedrigsten Huminstoffkonzentrationen, eine multiple Stressresistenz entwickelten und trotz täglichem Herausfangen mit dem Kescher so weiter wuchsen, als hätte es diesen Stress nie gegeben.
Bei Untersuchungen mit Karpfen entdeckte man weiterhin, dass sie thermischen Stress viel besser wegsteckten, wenn Huminstoffe im Wasser waren. Wenn sich also im Sommer unsere Aquarien gerne mal überdurchschnittlich erwärmen, dann können die Bewohner dies mit Huminstoffen besser bewältigen.
2.2.6 - Verbesserung der Mineralstoffaufnahme
Besonders in sehr stark huminstoffreichem und mineralarmem Wasser, wie es in der Natur, aber weniger in unseren Aquarien vorkommt, ermöglichen Huminstoffe, dass z.B. Mineralien aufkonzentriert werden können. Das ist für Fische in sehr saurem Wasser essentiell, denn normalerweise dürften sich gar keine Knochenstrukturen bilden, sondern sie müssten sich bei pH Werten von 3-4 sofort wieder auflösen. Durch Huminstoffe können die Tiere aber die mangelnden Mineralien anreichern und so erst existieren.
Wie erwähnt ist dies ein Punkt, der für uns Aquarianer nicht sonderlich relevant ist, da wir in der Regel keine solche sauren Milieus in unseren Aquarien haben, aber er sei dennoch kurz erwähnt, da er aufzeigt, wie wichtig Huminstoffe in der Natur sind.
Wichtig ist aber noch anzumerken, dass Tiere aus sehr stark huminstoffhaltigen Habitaten wie z.B. solche aus dem Rio Negro oder ähnlichen Flüssen unbedingt auch im Aquarium eine höhere Konzentration an Huminstoffen benötigen. Sie reagierten bei Versuchen besonders negativ auf Huminstoffmangel.
3 - Färbung des Wassers
Huminstoffe bestehen aus einer Vielzahl verschiedener Stoffe: Polyphenole (sekundäre Pflanzenstoffe), Chinone (Oxidationsprodukte), stabile Radikale (Atome, Moleküle) und viele andere mehr. Noch ist leider nicht entschlüsselt, welche einzelnen Stoffe welche Wirkung bei den Tieren und Pflanzen haben, und daher ist auch nicht klar, ob wir einzeln extrahierte farblose Stoffe für unsere Aquarien verwenden können, die dann dieselben zahlreichen Vorteile bringen wie die "ganzen" Huminstoffe. Dieser Nachweis wird auch noch eine Weile dauern, denn Huminstoffe sind sogenannte Geopolymere, das bedeutet, ihre Zusammensetzung ändert sich von Ort zu Ort und sogar an einem Ort je nach Jahreszeit. Dies macht es so schwierig, ihre Zusammensetzung zu entschlüsseln.
Wir können aber die färbende Eigenschaft von Huminstoffen als Hilfe für die Dosierung nutzen. Da sie in jedem Aquarium unterschiedlich schnell verbraucht werden, können wir besser die Zeit zur Nachdosierung abschätzen. Da schon geringe Mengen helfen, die das Wasser noch nicht deutlich sichtbar einfärben, sollte die leichte Färbung im Aquarium ohnehin nicht nachteilig auffallen.
4 - Laub und Erlenzapfen
Um langfristig Huminstoffe ins Aquarium zu bringen, eignen sich Laub und Erlenzapfen leider nur bedingt, man müsste sie hierfür auch alle 1-2 Wochen austauschen. Die darin enthaltenen Huminstoffe sind nicht sehr hoch konzentriert. Zwar hat man die ersten Tage einen schönen Effekt mit leicht bräunlichem Wasser. Nach relativ kurzer Zeit sind die Huminstoffe jedoch verbraucht, und es bleibt nur Biomasse im Aquarium, die keine weiteren Huminstoffe abgibt.
Dennoch finden wir, dass Blätter und/oder Erlenzapfen eine sehr schöne und natürliche Dekoration im Aquarium sind. Sie werden mit der Zeit von Bakterien zersetzt und vom Besatz gefressen, dem sie wichtige Ballaststoffe und Mineralstoffe liefern. Also, Daumen hoch für diese Dinge, aber um dauerhaft Huminstoffe im Wasser zu haben, muss man anders vorgehen.
5 - Huminstoffpräparat selber herstellen
Wer gerne mal im Wald unterwegs ist, kann leicht selber ein Huminstoffpräparat herstellen. Einfach z.B. die Streu (Fallaub) von Eiche, Buche oder Ahorn aufsammeln, zu Hause in Wasser einweichen und in einem Mixer zerkleinern, anschließend die "Suppe" durch einen Kaffeefilter laufen lassen. Die gewonnene Flüssigkeit ist reich an Huminstoffen und kann dann tropfenweise ins Aquarium gegeben werden.
Wer nicht diese Möglichkeit hat, dem bietet der Handel diverse Huminstoff-Produkte an.
6 - Dosierungsempfehlung
Huminstoffe sind leider nicht überall gleich, und so haben sicherlich die verschiedenen Produkte am Markt nicht alle den gleichen Grundstoff und somit die gleiche Wirkung. Da allerdings die Dosierung von Huminstoffen weniger wichtig ist als ihre bloße Anwesenheit, kann man vermutlich bei allen Produkten so gering dosieren, dass man nur eine minimale Färbung des Wassers erhält, die kaum wahrzunehmen ist.
Huminstoffe werden im Aquarium verwertet und sollten daher regelmäßig nachdosiert werden.
Wir empfehlen eine wöchentliche Zugabe, sodass sich das Wasser leicht bernsteinfarbig zeigt. Die leichte Färbung wird in der Regel von Tag zu Tag weniger, nach ungefähr einer Woche ist sie ganz vergangen. Dauert es länger, muss man natürlich auch erst später nachdosieren. Nach Wunsch kann auch höher dosiert werden, ein bräunliches Wasser hat ja auch optisch einen sehr schönen natürlichen Effekt.
6.1 - Tiere aus Schwarzwasser
Wer Tiere aus richtigen "Schwarzwasser-Habitaten" pflegt, der sollte generell auch Schwarzwasser bei sich im Aquarium herstellen. Diese Tiere benötigen deutlich höhere Konzentrationen an Huminstoffen.
6.2 - Achtung Überdosierung
Huminstoffpräparate sollten nicht stark überdosiert werden. Bei extrem hohen Huminstoff-Konzentrationen haben sich Nachteile gezeigt. Dies ist aber erst zu erwarten, wenn das Wasser so tief braun ist, dass man die Tiere hinterm Glas nicht mehr sehen kann - und so stark würde ja niemand sein Wasser einfärben.
7 - Fazit
Alle Tier- und Pflanzenarten in unseren Aquarien leben in ihren Habitaten in huminstoffreichen Gewässern. Sie nutzen die Huminstoffe direkt zu ihrem Vorteil, oder sie nutzen die indirekten positiven Wirkungen.
Huminstoffe
- stabilisieren den pH-Wert
- die Tiere haben schönere und leuchtendere Farben
- sie sind gesünder
- stressresistenter
- sie wachsen besser
- sie vermehren sich besser
- sie leben länger
- Pflanzen können Nährstoffe besser aufnehmen
Huminstoffe sollten daher in jedem Aquarium verwendet werden, die Tiere und Pflanzen werden es danken.
8 - Carsten Logemann im Interview mit Christian E. W. Steinberg
9 - Umweltstress, die lange übersehene ökologische Stellgröße
CHRISTIAN E. W. STEINBERG
Humboldt-Universität zu Berlin, Gewässer- und Stressökologie, Arboretum, Späthstr. 80/81, 12437 Berlin
Vortrag auf der wissenschaftlichen Sitzung am 17. März 2015
Abgedruckt in: Sitzungsberichte der Gesellschaft der Naturforschenden Freunde zu Berlin (Neue Folge) Band 52 (2016), S. 137-163. Mit Genehmigung des Vereins

Prof. Dr. Christian E. W. Steinberg
Emeritierter Professor für Gewässer- und Stressökologie, Humboldt-Universität zu Berlin, Germany
Gast Professor, Kunming Universität für Wissenschaft und Technologie, China
Herr Professor Dr. Steinberg schrieb seine Dissertation zum Thema Stickstoffhaltige gelöste organische Substanzen im Schöhsee und in Algenkulturen. Seit 1975 ist er Doktor der Naturwissenschaften und bereits damals wurde auch sein Interesse an Huminstoffen geweckt. 1987 erfolgte die Habilitation für Limnologie (Wissenschaft von Binnengewässern als Ökosystem). Er arbeitete von 1975 bis 1995 an verschiedenen Instituten, die sich mit Umwelt, Gewässerökologie, Ökotoxikologie und Gesundheit beschäftigen. So leitete er unter anderem die Limnologische Abteilung beim Bayerischen Wasserverband, die Abteilung für Angewandte Ökologie beim Frauenhofer Institut für Umweltchemie und Ökotoxikologie und die Abteilung für Aquatische Ökotoxikologie beim Münchner Institut für Ökologische Chemie, dessen Vizedirektor er auch war.
Von 1995 bis 2005 war er Direktor vom Leibniz-Institut für Gewässerökologie und Binnenfischerei und von 1995 bis 2014 lehrte er als Professor an der Humboldt-Universität zu Berlin im Fachbereich Gewässer- und Stressökologie. Herr Professor Dr. Steinberg leitete viele Studien zum Thema Huminstoffe und arbeitete an zahlreichen Forschungsarbeiten mit. Seit 2014 ist er emeritierter Professor und genießt somit mehr oder weniger ruhig den wohlverdienten Ruhestand.
Abstract: Environmental stress, the overlooked ecological driving force. Humic substances are a major carbon reservoir on Earth and are present in all ecosystems. Humic substances are natural xenobiotic compounds and therefore pose a chemical challenge for aquatic animals that need to reallocating energy to stress defense that could otherwise be used for growth, reproduction or body maintenance. However stress by humic substances can improve the Darwinian fitness of animals, and is an essential prerequisite for them to exist in fluctuating environments. The following examples of physiological and molecular biological effects of humic substances on animals are reviewed here:
- Relative immiscibility of the Baikalian and Palearctic amphipod faunas: Measurements of basic HSP70 levels and HSP70 levels after exposure to a humic substance demonstrated that Baikalian amphipods are more sensitive to humic stress than Palearctic amphipods. This difference in the response to a natural challenge may be one reason for the non-overlapping distribution (“relative immiscibility”) of the Baikalian and Palearctic amphipod faunas.
- Feminization of lower vertebrates: Feminizing activity via the estrogenic and the anti-androgenic pathway appears to be an intrinsic property of humic substances. Exposure to these natural xenobiotics decreases the male-to-female ratio in lower vertebrates and may reduce the maintenance costs for two separate parental bodies. Hence, available energy may be reallocated to reproduction trait.
- Hormetic modulation of life trait variables: From the ecological perspective, hormesis is a mild stress that improves Darwinian fitness rather than a single life-trait variable. Specifically, the mitochondrial hormesis hypothesis states that a certain increase of reactive oxygen production leads to lifespan extension and, in the case of the puddle cladoceran Moina macrocopa, also to increased offspring numbers. This newly discovered phenomenon might act to stabilize populations in fluctuating environments.
- Multiple stress resistance or cross-tolerance: Exposure to humic substances induces a general multiple stress tolerance in exposed animals. Examples include tolerance to predation (netting) stress in fish and osmotic stress in Moina. Furthermore, evidence is accumulating that exposure to humic substances increases the fitness also of other invertebrates, e.g. shrimps and mayflies.
- Transgenerational heritage of stress resistance: One of the most promising strategies to stabilize long-term.
9.1 - Umweltstress, die lange übersehene ökologische Stellgröße
„Nicht jeder Stress ist wirklich stresshaft“. In einer Zeit, in der sich fast jeder durch die Arbeitsbelastungen und -anforderungen, das alltägliche Tempo oder die familiäre Situation gestresst, unwohl und gesundheitlich eingeschränkt fühlt, klingt dieser Satz provokant. Doch schon der Begründer der modernen Stressforschung, Hans SELYE, unterschied letztlich bereits zwischen Eustress (positivem Stress) und Dysstress (negativem Stress) (SELYE 1936, 1955). Nur der letztgenannte hat Eingang in den allgemeinen Sprachgebrauch gefunden und dadurch den Blick auf wichtige Phänomene stark verengt. Positivem sowie negativem Stress sind aber nicht nur Menschen ausgesetzt, sondern alle Lebewesen, denn selten sind für die betrachteten Organismen alle Umweltfaktoren gleichzeitig im optimalen Bereich. Und bereits jede deutliche Abweichung von der Optimaltemperatur, der Optimalstrahlung, der Optimalfeuchte des Lebensraumes, einem ausreichenden Nahrungs- oder Nährstoffangebot ist bereits ein Stress, auf den der Mikroorganismus, die Pflanze, der Pilz oder das Tier reagieren muss und sehr oft auch erfolgreich reagiert. Sind diese Reaktionen stofflicher Natur, wie bei Pflanzen viele so genannte pflanzliche Sekundärmetabolite, dann können die Produkte sogar zum Beispiel gegen Fressfeinde als so genannte Repellents eingesetzt werden (CLOSE & MCARTHUR 2002). Wenn der gegenseitige „chemische Rüstungswettlauf“ zwischen Pflanzen und Tieren lange genug währte und damit zu einer Koevolution geführt hat, dann können Tiere den ursprünglich nachteiligen Stress in einen fördernden umkehren, wie an der gesundheitsfördernden Wirkung von Polyphenolen, den bekanntesten natürlichen Xenobiotika, erkennbar wird (beispielsweise in Blaubeeren oder Grünem Tee). Dies gilt auch für andere natürliche Xenobiotika, wie Huminstoffen (STEINBERG et al. 2007). (Xenobiotika sind chemische Verbindungen, die einem Organismus fremd sind.)
 Abb. 1: Der Baikalsee. Oben: Bucht mit einem Schamanen-Felsen nahe der Siedlung Bolshye Koty. Unten: Durch Huminstoffe braun gefärbte Zuflüsse bei der Bahnstation Polovinnyj, Südost-Baikal. Fotos: Chr. STEINBERG.
Abb. 1: Der Baikalsee. Oben: Bucht mit einem Schamanen-Felsen nahe der Siedlung Bolshye Koty. Unten: Durch Huminstoffe braun gefärbte Zuflüsse bei der Bahnstation Polovinnyj, Südost-Baikal. Fotos: Chr. STEINBERG.
In allen Böden und Gewässern ist der größte Teil der organischen Kohlenstoffverbindungen nicht in Organismen festgelegt, sondern im Detritus, der in Gewässern zumeist in gelöster Form vorliegt (WETZEL 2001). Der größte Anteil des gelösten Detritus wird von Huminstoffen gestellt, von denen Gewässerökologen irrigerweise annahmen, sie seien inert. Huminstoffe sind natürliche Xenobiotika. Seit geraumer Zeit liegen Belege dafür vor, dass sie - wenn auch meistens in abgeschwächter Form - gleichwohl dieselben Stressabwehr-Reaktionen hervorrufen wie synthetische Xenobiotika (z. B. Pestizide, Industriechemikalien) (STEINBERG et al. 2003). Denn Huminstoffe besitzen eine Vielzahl von reaktiven Gruppen, und die kleineren Moleküle können von Organismen aufgenommen werden, denn ihre Größe liegt um 0,5 kDa (REEMTSMA & THESE 2005). Folgt man den gängigen Toxikologie- und Ökotoxikologie-Lehrbüchern, sollte man annehmen, dass bewegliche Tiere derartige Umwelten meiden, da Abwehrreaktionen gegen jede Form von Xenobiotika Energie benötigt (CAZENAVE et al. 2006), also ein Stress ist. Und warum sollten die Tiere unnötigerweise Energie verschwenden? Sie tun es, und wir werden auf dieses scheinbar widersinnige Verhalten noch ausführlich zu sprechen kommen.
 Abb. 2: Gammariden aus dem Baikal-Gebiet. Oben: Gammarus lacustris, eine der wenigen paläarktischen Arten im Gebiet (rd. 1,5 cm groß). Mitte: Eulimnogammarus verrucosus Gerstf., eine endemische Art im Baikal (rd. 5 cm groß). Unten: Eulimnogammarus cyaneus Dyb., eine weitere endemische Art (rd. 1,2 cm groß). Fotos: Vasiliy V. PAVLICHENKO, Irkutsk, Russland.
Abb. 2: Gammariden aus dem Baikal-Gebiet. Oben: Gammarus lacustris, eine der wenigen paläarktischen Arten im Gebiet (rd. 1,5 cm groß). Mitte: Eulimnogammarus verrucosus Gerstf., eine endemische Art im Baikal (rd. 5 cm groß). Unten: Eulimnogammarus cyaneus Dyb., eine weitere endemische Art (rd. 1,2 cm groß). Fotos: Vasiliy V. PAVLICHENKO, Irkutsk, Russland.
Doch zuvor ein anderes Beispiel, in dem Huminstoffe tatsächlich als negativer Stressor auftreten könnten. Dieser negative Stress könnte nämlich der Mechanismus sein, der der Nichtmischbarkeit der endemischen Baikal-Fauna mit der umliegender Gewässer zugrunde liegt. Der größte und älteste Süßwassersee der Welt, der Baikalsee (Abb. 1), beherbergt eine Vielzahl von Tierarten, die nur dort vorkommen. Zum Beispiel kommen von den rund 400 Süßwasserarten der Amphipoden auf der Welt allein rund 350 nur im Baikal vor (Abb. 2). Von diesen verlassen nur sehr wenige Arten den See über die Angara, den reißenden Abfluss des Sees. So bilden nicht mehr als 20 Arten bei Irkutsk noch stabile Populationen, mit weiter abnehmender Tendenz (PROTOPOPOVA et al. 2014, mit Verweisen auf die russischen Originalarbeiten). Die umliegenden Gewässer sind mit der vergleichsweise artenarmen paläarktischen Amphipoden-Fauna ausgestattet, deren häufigster Vertreter Gammarus lacustris Sars ist (Abb. 2).
Warum wandern die paläarktischen Amphipoden nicht in den Baikal und bilden dort stabile Populationen? Mit Sicherheit werden sie aus Kleingewässern eingeschwemmt, die mit dem Baikal durch Fließgewässer verbunden sind; doch werden sie in dessen Litoral rasch Beute der dort lauernden großen, farbigen Amphipoden, wie dem Eulimnogammarus verrucosus, der rund dreimal größer als der einwandernde G. lacustris ist. Der größere frisst stets den kleineren, wie BEREZINA (2009) empirisch nachwies. War diese Frage noch leicht zu beantworten, so bereitete die Antwort auf die umgekehrte Frage einiges Kopfzerbrechen: Warum sind so wenig Amphipoden des Baikals in der Lage, sich außerhalb des Sees zu behaupten? Vergleicht man das Wasser des Baikals allein durch optische Inspektion, dann fällt seine fast vollständige Farblosigkeit auf. Es ist fast wie destilliertes Wasser, während die Kleingewässer im Einzugsgebiet und die Zuflüsse zum Baikal gelblich bis bräunlich gefärbt sind (Abb. 1). Die entsprechenden Huminstoff-Analysen sind bei PROTOPOPOVA et al. (2014) zu finden. Diese zeigen auf, dass selbst recht farblose Kleingewässer im Einzugsgebiet noch mehr als doppelt so viele Huminstoffe wie der Baikal selbst enthalten. Ein erster Test mit Amphipoden aus der Tiefe im Vergleich mit denen aus dem Litoral des Baikal erbrachte, dass die Tiefenarten auf Huminstoff-Stress nicht ausreichend flexibel reagierten (TIMOFEYEV & STEINBERG 2006). Aufgrund der geringen physikalischen und chemischen Fluktuationen in ihrem Lebensraum hatten sie den Abwehrmechanismus gegen Stresssituationen quasi aus Kostengründen verkümmern lassen - ein durchaus gängiger Mechanismus bei Tieren in sehr stabilen Umwelten (STEINBERG 2012).
Bei biochemischen und biomolekularen Variablen traten in der Tat bei G. lacustris auf der einen Seite und den Baikal-Arten auf der anderen Seite deutliche Unterschiede zutage. Während G. lacustris auf die Exposition gegen Huminstoffe mit verstärkter Transkription und Produktion des Stressproteins (heat shock proteins) 70 (HSP70) und mit erhöhter Transkription eines Exporterproteins reagierte, das aufgenommene Huminstoffe rasch wieder aus dem Körper transportieren kann, passierte bei den Baikal-Arten entweder gar nichts oder sie reduzierten sogar die Transkription dieser Gene (PROTOPOPOVA et al. 2014). Es steht deshalb zu vermuten, dass weitere Stressoren in der fluktuierenden Umwelt außerhalb des Baikals von seinen endemischen Amphipoden nicht verkraftet werden können. Dies ist einer von sicherlich mehreren Mechanismen für die relative Nichtmischbarkeit der beiden Faunen.
9.2 - Huminstoffe fördern Weiblichkeit
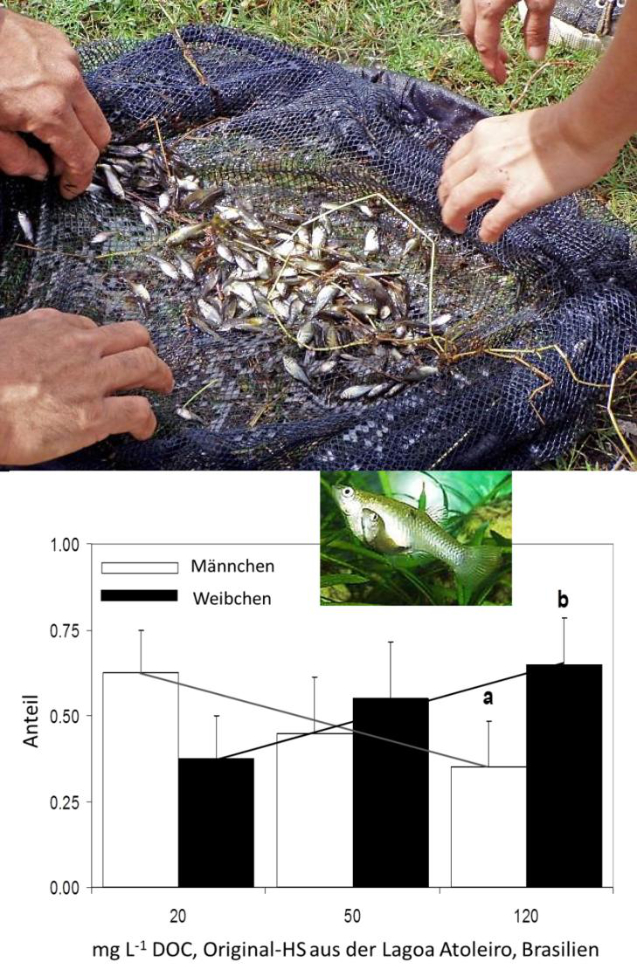 Abb. 3: Fische in der Lagoa Atoleiro, Macaé, Staat Rio de Janeiro, Brasilien. Oben: Die erste Bestandsaufnahme erbrachte 2007 Individuen des Roten von Rio und des Augenfleck-Kärpflings. Foto: Chr. STEINBERG. Unten: Geschlechterverhältnis bei den Überlebenden der jungen Augenfleck-Kärpflinge (Poecilia vivipara) nach 120-tägiger Exposition gegen steigende Huminstoff-Konzentrationen (Angaben in mg L-1 DOC von Huminstoffen aus der Lagoa Atoleiro). Die Buchstaben a und b zeigen Geschlechterverhältnisse an, die signifikant von 1:1 abweichen (PETRY, SUHETT, CORREIA, FARJALLA & STEINBERG, unveröffentlicht).
Abb. 3: Fische in der Lagoa Atoleiro, Macaé, Staat Rio de Janeiro, Brasilien. Oben: Die erste Bestandsaufnahme erbrachte 2007 Individuen des Roten von Rio und des Augenfleck-Kärpflings. Foto: Chr. STEINBERG. Unten: Geschlechterverhältnis bei den Überlebenden der jungen Augenfleck-Kärpflinge (Poecilia vivipara) nach 120-tägiger Exposition gegen steigende Huminstoff-Konzentrationen (Angaben in mg L-1 DOC von Huminstoffen aus der Lagoa Atoleiro). Die Buchstaben a und b zeigen Geschlechterverhältnisse an, die signifikant von 1:1 abweichen (PETRY, SUHETT, CORREIA, FARJALLA & STEINBERG, unveröffentlicht).
In der verfügbaren Literatur wurde gelegentlich berichtet, dass Exposition von Huminstoffen bei niederen Wirbeltieren das Geschlechterverhältnis beeinflusst und zu einem Überschuss an Weibchen in den betroffenen Populationen führt. Zwischenzeitlich konnte dies über biomolekulare Ansätze zweifelsfrei nachgewiesen werden, und zwar entfalten Huminstoffe sowohl östrogene als auch anti-androgene Aktivitäten (LUTZ et al. 2005, HERMELINK et al. 2010, BITTNER et al. 2012). Histologisch konnte die Förderung des weiblichen Anteils von Nachkommen unter anderem bei dem Schwertträger Xiphophorus helleri Heckel (MEINELT et al. 2004) und dem Krallenfrosch Xenopus laevis Daudin (LUTZ et al. 2005) nachgewiesen werden. Allerdings waren die Huminstoff-Konzentrationen, die letztlich das weibliche Geschlecht überwiegen ließen, so hoch, dass sie selbst für die meisten an Huminstoffen reichen Gewässer unrealistisch waren.
1 DOC = Dissolved Organic Carbon, gelöster organischer Kohlenstoff, ist das analytische Maß u. a. für aquatische Huminstoffe.
Deshalb wurde jüngst ein ähnlicher Versuch mit frisch geborenem Nachwuchs des Augenfleck-Kärpflings (Poecilia vivipara Bloch & Schneider) und autochthonen Huminstoffen durchgeführt. Diese Kärpflingsart ist neben dem Salmler Roter von Rio (Hyphessobrycon flammeus Myers) eine der wenigen Fischarten, die die sauren Lebensbedingungen in der Lagoa Atoleiro (pH um 3.5) ertragen können (Abb. 3). Da die Huminstoff-Gehalte (200-250 mg-1 DOC) dieser Lagune ausreichend hoch waren, konnten die Expositions-Konzentrationen durch Verdünnung hergestellt und deshalb mögliche Artefakte durch Aufbereitung vermieden werden1. Diese Huminstoff-Exposition der frisch geschlüpften Kärpflinge führte zu einer eindeutigen Verschiebung des Geschlechter-Verhältnisses zugunsten der Weibchen (Abb. 3). Die effektive Konzentration lag bei 120 mg L-1 DOC, damit zwar innerhalb des Konzentrations-Bereiches der Lagoa Atoleiro, aber deutlich über den DOC-Konzentrationen der meisten Gewässer auf der Welt, die selten 10 mg L-1 DOC überschreiten (WETZEL 2001). Gleichwohl scheint sich die verweiblichende Aktivität der Huminstoffe (LUTZ et al. 2005, BITTNER et al. 2012) auch allgemein in Tieren niederzuschlagen, denn bei dem Nematoden Caenorhabditis elegans Maupas konnte nach Huminstoff-Exposition stets eine Transkription des vit-6-Gens beobachtet werden (Abb.4). Das Gen vit-6 kodiert für einen Vorläufer des Dotterproteins und zeigt somit die Bildung von Eiern an, also Verweiblichung. Aus diesem Grunde sei es nachfolgend erlaubt, die Sinnhaftigkeit des Überwiegens von Weibchen in realen Populationen kurz zu diskutieren.
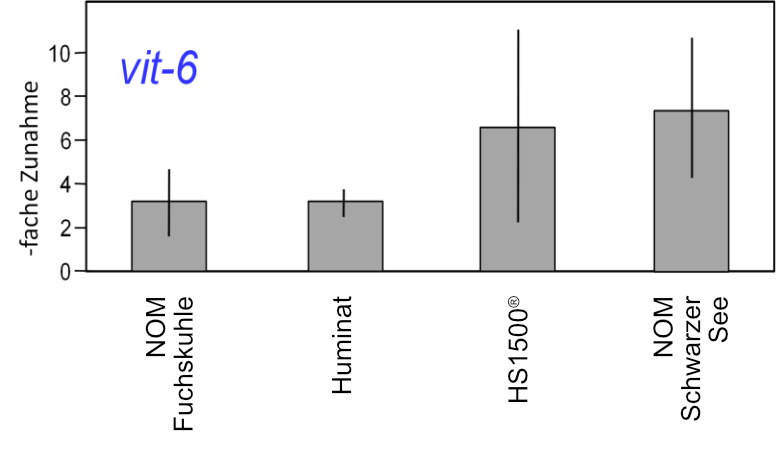 Abb. 4: Relative Expression des vit-6-Gens in Caenorhabditis elegans bei Exposition gegen 25 mg L-1 DOC verschiedener Huminstoffe aus Seen im Berliner Umland, einem Boden-Isolat (Huminat) und einer synthetischen Substanz (HS1500®). NOM = Natural Organic Matter, gelöste organische Substanzen, isoliert durch Umkehrosmose und nicht aufgetrennt in verschiedene Fraktionen. Zunahmen der Transkripte von >1,7- fach wurden als signifikant angesehen. Normalisierung erfolgte mit dem Referenzgen act-1 (WILD, STAUDACHER, MENZEL & STEINBERG unveröffentlicht).
Abb. 4: Relative Expression des vit-6-Gens in Caenorhabditis elegans bei Exposition gegen 25 mg L-1 DOC verschiedener Huminstoffe aus Seen im Berliner Umland, einem Boden-Isolat (Huminat) und einer synthetischen Substanz (HS1500®). NOM = Natural Organic Matter, gelöste organische Substanzen, isoliert durch Umkehrosmose und nicht aufgetrennt in verschiedene Fraktionen. Zunahmen der Transkripte von >1,7- fach wurden als signifikant angesehen. Normalisierung erfolgte mit dem Referenzgen act-1 (WILD, STAUDACHER, MENZEL & STEINBERG unveröffentlicht).
Bei einem Geschlechterverhältnis von 1:1 werden mehr oder weniger gleich viele Ressourcen zur Produktion von Nachkommen aufgewandt, was im Allgemeinen als stabile evolutionäre Strategie angesehen wird (FISHER 1930, CONOVER & VAN VOORHEES 1990). Doch trifft diese theoretische Betrachtung tatsächlich in der realen Welt zu? Natürlicherweise sind viele Fischpopulationen durch Weibchen dominiert, ohne dass die Mechanismen bisher im Detail verstanden sind (BOHLEN et al. 2008). Entgegen des theoretischen Postulats scheint die Rekrutierung von Nachwuchs in realen Populationen selten unter dem „nicht ausgewogenen“ Geschlechterverhältnis zu leiden (ROOD & REZNICK 1997, BOHLEN et al. 2008), es sind vielmehr meist anthropogene Eingriffe, die zum Einbruch in Fischpopulationen führen. Warum sollte auch das Geschlechterverhältnis die Ursache sein? Es gibt eher Argumente, die für eine Stabilisierung der Population durch das „nicht ausgewogene“ Geschlechterverhältnis sprechen, insbesondere in solchen Gewässern, deren Tragfähigkeit sehr begrenzt ist wie in den Braun- und Schwarzwässern. Deren Primärproduktion ist nämlich vergleichsweise gering (JÖNSSON et al. 2012); und warum sollte sich, um es anthropozentrisch auszudrücken, solch ein System den Luxus erlauben, zwei Geschlechter in gleichen Individuendichten zu halten, um Nachwuchs zu produzieren? Ist es dagegen nicht sinnvoller, die wenige vorhandene Energie bevorzugt dem Geschlecht zukommen zu lassen, das für die Aufrechterhaltung der Population das wichtigere ist? Um eine ausreichende Rekombination innerhalb einer Population sicherzustellen, dürfte das Geschlechterverhältnis durchaus von 1:1 abweichen, wenn die verfügbare ökosystemare Energie überwiegend in die Weibchen geht und der Luxus, zwei unabhängige Körper unterschiedlichen Geschlechts aufrechtzuerhalten und die Männchen nur für die Reproduktion vorzuhalten, minimiert wird. Diese Annahme wird noch dadurch unterstützt, dass Weibchen meistens die Nahrung effektiver verwerten können als Männchen (z. B. PANDIAN 1970).
9.3 - Steigerung von Nachkommenzahl und Lebensdauer durch Huminstoff-Stress
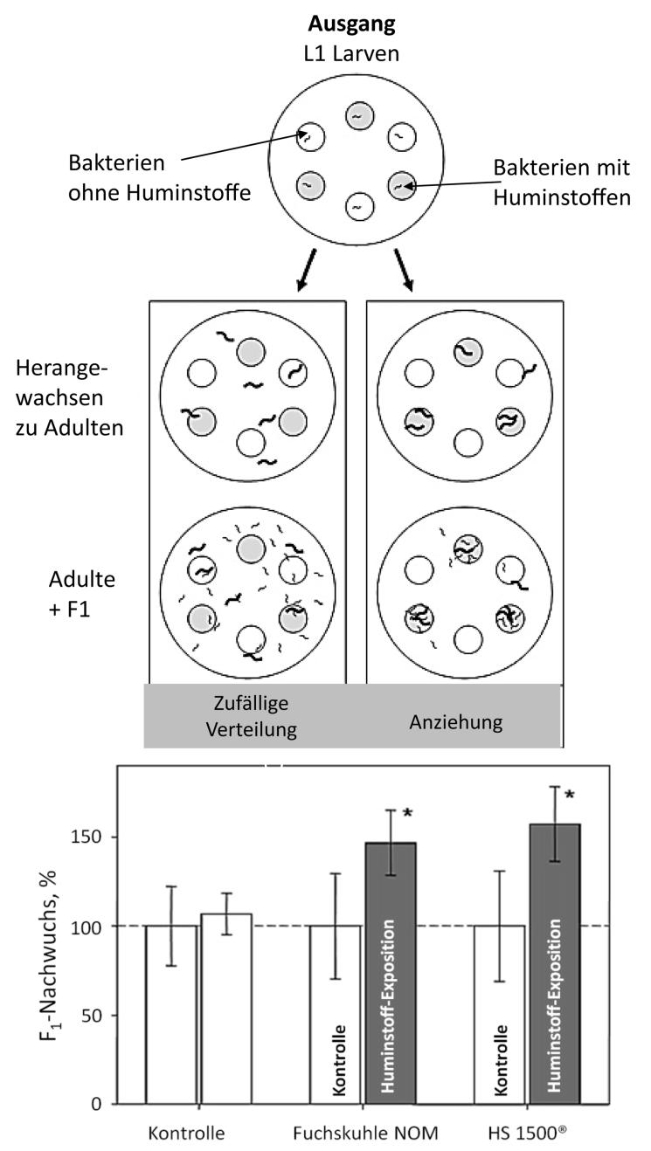 Abb. 5: Attraktionstest mit C. elegans. Den Nematoden wurden Bakterienhaufen angeboten, die abwechselnd mit und ohne zwei unterschiedlichen Huminstoffen versehen waren. Nach einer gewissen Zeit wurden die Nachkommen ausgezählt. Die meisten Nachkommen waren auf den Huminstoff-Haufen zu finden (aus MENZEL et al. 2005, mit Genehmigung der American Chemical Society).
Abb. 5: Attraktionstest mit C. elegans. Den Nematoden wurden Bakterienhaufen angeboten, die abwechselnd mit und ohne zwei unterschiedlichen Huminstoffen versehen waren. Nach einer gewissen Zeit wurden die Nachkommen ausgezählt. Die meisten Nachkommen waren auf den Huminstoff-Haufen zu finden (aus MENZEL et al. 2005, mit Genehmigung der American Chemical Society).
Die Aussage, dass ein Huminstoff-Stress nur negativ ist, gilt nicht für alle Tiere, wie das Amphipoden-Beispiel vermuten lässt. Viele Tiere, vor allem jene, die in fluktuierenden Umwelten leben, haben aus dem Stress durch Huminstoffe einen Vorteil für sich gezogen. Sie geben Energie zur Stressabwehr durch Huminstoffe aus, gewinnen aber dadurch für ihre Population wichtige Vorteile. Im Folgenden seien einige dieser Vorteile aufgeführt2. So war es bei C. elegans, denn er zog eindeutig die stresshafte, huminstoffhaltige Umwelt den nackten Laborumwelten vor, die er (in einem nicht dargestellten Versuch) aktiv aufsuchte und dort bevorzugt seine Nachkommen in die Welt entließ (Abb. 5). Auf den Bakterienhaufen mit Huminstoffen wurden bis zu 50% mehr Nachkommen gefunden als auf den huminstofflosen. Bemerkenswert an diesem Versuch war ferner, dass neben etlichen Stressgenen besonders olfaktorische und chemosensorische Gene herauf reguliert waren. Das zeigt, dass C. elegans diese Umwelt wahrnahm, um sich dorthin zu begeben. Warum legte der Nematode diese scheinbar widersinnige Verhaltensweise an den Tag, bei der Energie zur Stressbeseitigung aufgewandt werden musste? Welchen Gewinn trug er davon? Und gibt es weitere Beispiele für ähnliches Verhalten?
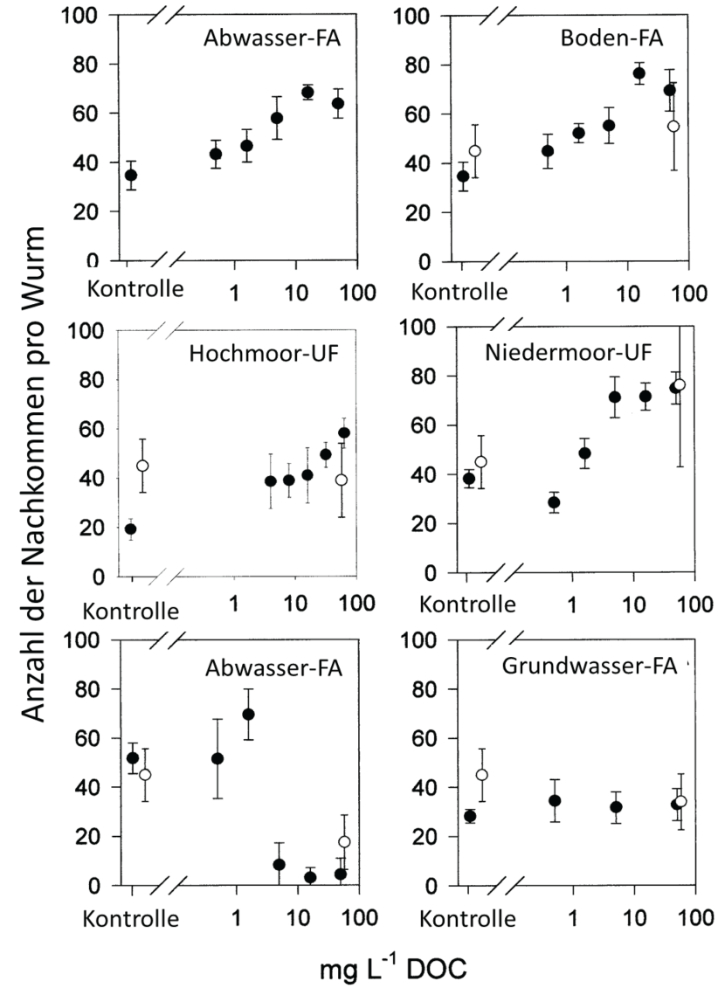 Abb. 6: Anzahl der Nachkommen pro Wurm in zwei unabhängigen Ansätzen mit unterschiedlichen Huminstoff-Präparaten: Abwasser-Fulvosäure (FA), Boden FA, Hochmoor-Ultrafiltrat (UF), Niedermoor-UF, Abwasser-FA sowie Grundwasser-FA (aus HÖSS et al. 2001, mit Genehmigung von John Wiley & Sons).
Abb. 6: Anzahl der Nachkommen pro Wurm in zwei unabhängigen Ansätzen mit unterschiedlichen Huminstoff-Präparaten: Abwasser-Fulvosäure (FA), Boden FA, Hochmoor-Ultrafiltrat (UF), Niedermoor-UF, Abwasser-FA sowie Grundwasser-FA (aus HÖSS et al. 2001, mit Genehmigung von John Wiley & Sons).
Die ersten Hinweise über Vorteile durch „Huminstoff-Stress“ kamen von C. elegans-Kulturen, die offensichtlich unter suboptimalen Bedingungen gehalten wurden, denn die Hermaphroditen reproduzierten im gesamten Leben nur 50 bis 100 Nachkommen (HÖSS et al. 2001) (Abb. 6), während die maximale Reproduktionsrate sonst zwischen 250 bis knapp 300 Nachkommen liegt (SAUL et al. 2010). Wurden nun in der ersten Versuchsserie die Tiere gegen Huminstoffe unterschiedlicher Herkunft und Präparation exponiert, nahmen bei vielen (allerdings nicht bei allen Präparaten) die Nachkommenzahlen deutlich zu (HÖSS et al. 2001). Das Präparat aus einem Hochmoorsee im Schwarzwald führte zu einer eindeutigen hormetischen Dosis-Wirkungsbeziehung3. Die Situation dieses Versuches dürfte der Lage der Tiere in der realen Umwelt nahekommen: Nahrung wird hier mit Sicherheit weniger üppig angeboten als in optimierten Laborversuchen. Dies bedeutet, dass der beobachtete Effekt einer Fertilitätssteigerung durch Huminstoff-Exposition in Freilandpopulationen durchaus auftreten kann und durch die Erhöhung der Nachkommenzahlen zu einer nachhaltigen Stärkung der Population in ihrem Lebensraum beiträgt.
2 In unseren Versuchen haben wir oft mit synthetischen Huminstoff-Präparaten gearbeitet, und zwar aus zwei Gründen: (1) weil wir eine mögliche Kontamination von Huminstoffen aus der Umwelt ausschließen wollten und (2) weil eine gleichbleibende Qualität für die anstehenden Versuche gewährleistet sein sollte. Die Charakterisierungen dieser Präparate ist MEINELT et al. (2007) zu entnehmen.
3 Hormesis (von Altgriechisch „hormáein“ = Anstachelung) ist dosisabhängiger Umkehreffekt und besagt somit, dass eine niedrige Dosis eines Stressors in Organismen die entgegengesetzte Reaktion im Vergleich zu einer hohen Dosis auslöst. Mit seiner klassischen Formulierung „Alle Dinge sind Gift, und nichts ist ohne Gift; allein die Dosis macht‘s, dass ein Ding kein Gift sei“ wird angenommen, dass bereits der Schweizer Arzt PARACELSUS (1493-1541) auf das Phänomen der Hormesis hingewiesen hat. Nach heutigen wissenschaftlichen Kriterien wurde dieses Wirkprinzip erstmals von Rudolf VIRCHOW in Würzburg beschrieben (HENSCHLER 2006) und nicht von dem Berliner Homöopathie-Jünger Hugo SCHULZ - wie es leider in zugänglichen lexikalischen Werken zu lesen ist -, der sicherlich durch seine esoterische Haltung die wissenschaftliche Bearbeitung dieses Phänomens desavouierte und verzögerte.
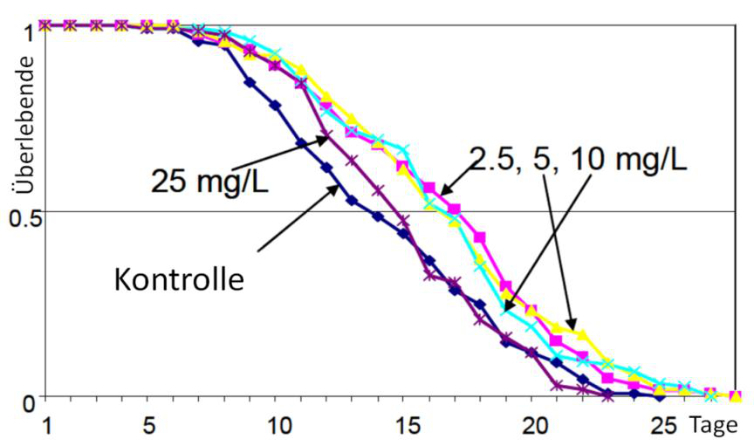 Abb. 7: Lebensspannen von C. elegans, der gegen ein Huminstoff-Präparat exponiert wurde. Die mittlere Lebensspanne wird in hormetischer Weise verlängert (aus STEINBERG et al. 2007, mit Genehmigung der Northeastern University, Boston, MA).
Abb. 7: Lebensspannen von C. elegans, der gegen ein Huminstoff-Präparat exponiert wurde. Die mittlere Lebensspanne wird in hormetischer Weise verlängert (aus STEINBERG et al. 2007, mit Genehmigung der Northeastern University, Boston, MA).
Unter den Bedingungen des Huminstoff-Stresses wurde auch die Lebensdauer als bedeutende Lebensvariable beeinflusst, und zwar ebenfalls in hormetischer Weise. Huminstoff-Konzentrationen von 2,5 bis 10 mg L-1 DOC (0,2 bis 0,83mM DOC) verlängerten die Lebensspanne von C.elegans signifikant, während die höchste angewandte Expositions-Konzentration von 25 mg L-1 (2,08 mM DOC) diese nicht modulierte, sondern gleiche Ergebnisse wie in der Kontrolle lieferte (Abb. 7). Hormesis wurde lange Zeit vereinfacht als „adaptive Anpassung“ (adaptive response) an Stresssituationen aufgefasst, mit der sich ein Organismus unter Stress quasi auf eine spätere Stresssituation vorbereitet (CALABRESE & BALDWIN 2002). Nach neueren Ergebnissen ist diese Auffassung in dieser Einfachheit nicht mehr gültig, denn Transkriptionsanalysen an verschiedenen Tieren zeigen vermehrt, dass bei niedrigen und hohen Expositionsdosen unterschiedliche Regulationswege an- und abgeschaltet werden (CELORIO-MANCERA et al. 2011, CALABRESE 2013, STEINBERG et al. 2013).
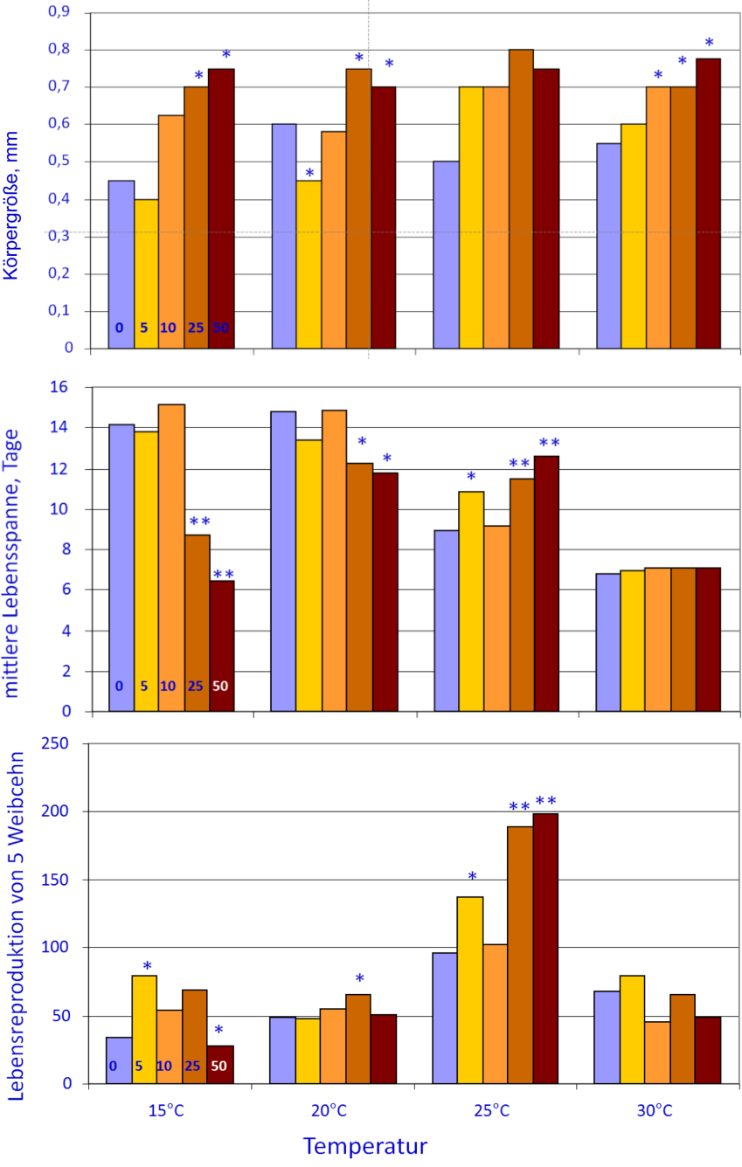 Abb. 8: Körpergröße, Lebensspanne und Reproduktion von Moina macrocopa, abhängig von steigenden Temperaturen und steigenden Huminstoff-Konzentrationen (Angaben in mM DOC). * zeigen signifikante Unterschiede zur jeweiligen Gruppenkontrolle ohne Huminstoffe an (aus ENGERT et al. 2013, mit Genehmigung von Elsevier).
Abb. 8: Körpergröße, Lebensspanne und Reproduktion von Moina macrocopa, abhängig von steigenden Temperaturen und steigenden Huminstoff-Konzentrationen (Angaben in mM DOC). * zeigen signifikante Unterschiede zur jeweiligen Gruppenkontrolle ohne Huminstoffe an (aus ENGERT et al. 2013, mit Genehmigung von Elsevier).
Das beobachtete Phänomen, nämlich dass unter Stress die Lebensspanne verlängert werden kann, ist populationsbiologisch bei Tieren, die während ihres Lebens nur eine begrenzte Reproduktionsphase erleben - wie bei C. elegans - nicht von Bedeutung. Anders ist es bei solchen, die sich ihr Leben lang reproduzieren können. Zu letzteren gehören die Cladoceren, von denen der Große Wasserfloh (Daphnia magna Straus) und der Japanische Kugelwasserfloh (Moina macrocopa Straus) diesbezüglich untersucht wurden. Bei beiden Arten trifft man selbst bei absterbenden Muttertieren noch auf lebensfähige Jungtiere im Brutraum. Bei M. macrocopa zeigte sich am deutlichsten, dass leichter Umweltstress sehr förderlich ist, und zwar auf die hinsichtlich der Populationsdynamik wichtigste Variable, nämlich die Reproduktion. Hierzu wurde als erster Schritt über den antioxidativen Status ermittelt, welches die Optimaltemperatur war. Heraus kam 20 °C, denn hier war der oxidative Stress am geringsten (ENGERT et al. 2013). Temperaturen sowohl oberhalb als auch unterhalb dieses Optimums verminderten das antioxidative Potenzial, erhöhten somit den internen oxidativen Stress. Erwartungsgemäß sollten sich bei dieser Temperatur die interessierenden Lebensvariablen manifestieren. Diese Erwartung traf zwar für Körpergröße und Lebensspanne zu, aber nicht für die Reproduktion während der Lebenszeit. Diese war bei 25 °C, somit bei leichtem oxidativen „Stress“ am besten und wurde noch gesteigert, wenn ein zweiter Stressor in Form von gelösten Huminstoffen hinzugefügt wurde. Je höher die Huminstoff-Konzentration wurde, desto besser reproduzierten die Moina-Weibchen (Abb. 8). Bei der höchsten Konzentration war die Reproduktion bei 25 °C rund dreimal so hoch wie bei dem Temperaturoptimum von 20 °C. Dieser erstaunliche Befund lässt sich mit der aufkommenden Mitohormesis-Hypothese (SCHULZ et al. 2007) erklären, nach der ein gewisses Niveau an reaktivem Sauerstoff lebensnotwendig ist, das zur Kommunikation innerhalb von und zwischen Zellen dient. Oder anders herum: Werden Organismen Antioxidantien in zu hohen Dosen zugeführt, dann sind diese nicht nur unnütz, sondern es treten deutlich schädliche Effekte auf, wie verzögerte Erholung nach körperlicher Anstrengung (RISTOW & SCHMEISSER 2014). In dem Japanischen Kugelwasserfloh M. macrocopa, der in stark fluktuierenden kleinen Gewässern lebt, führt die Mitohormesis zu einer nachhaltigen Behauptung der Population mittels der deutlich erhöhten Vermehrungsrate unter Stress.
9.4 - Moina macrocopa kann nach Umweltstress Nachkommenzahl und Stresstoleranz erhöhen
 Abb. 9: Zwei Küstenlagunen im Staate Rio de Janeiro, Brasilien. Oben: Lagoa Comprida (um 50 mg L-1 DOC) mit Atlantischem Ozean im Vordergrund. Foto: Romulo CAMPOS, Rio de Janeiro. Unten: Teil der Lagoa Atoleiro (200 bis 250 mg L-1 DOC). Foto: Chr. STEINBERG.
Abb. 9: Zwei Küstenlagunen im Staate Rio de Janeiro, Brasilien. Oben: Lagoa Comprida (um 50 mg L-1 DOC) mit Atlantischem Ozean im Vordergrund. Foto: Romulo CAMPOS, Rio de Janeiro. Unten: Teil der Lagoa Atoleiro (200 bis 250 mg L-1 DOC). Foto: Chr. STEINBERG.
Die kurzlebige Moina war ein sehr geeigneter Kandidat für nachfolgende Versuche, die weitere Wirkungen des Huminstoff-Stresses und mögliche Mechanismen herausarbeiten sollten. Die von uns verwendete Art und nahe verwandte Arten leben unter anderem in Küstenlagunen des Staates Rio de Janeiro. Dies sind huminstoffreiche Flachgewässer, in die bei Sturm der Atlantik mit seiner Salzfracht einbricht (Abb. 9). Für die nachhaltige Existenz von Tieren in diesen Gewässern ist es essenziell, dass die diversen Stressoren wie stark fluktuierende Temperaturen oder erhöhter osmotischer Stress ertragen werden. Die Arbeitshypothese war, dass Huminstoffe und Organismen sich gemeinsam entwickelt hatten, sodass genügend Zeit blieb, dass die ursprünglich durch die natürlichen Xenobiotika gestressten Tiere diesen Stress in eine positive Leistung für sich umkehren konnten - im Gegensatz zu synthetischen, vom Menschen in die Umwelt eingebrachten, die überwiegend schädigend wirken. Mit anderen Worten, die Huminstoffe könnten als Trigger für eine breite Resistenz in den Tieren wirken, die unter Umständen sogar an nachfolgende Generationen weitergegeben werden könnte. Damit wäre sichergestellt - ohne dass eine Mutation nötig wäre -, dass sich Populationen rasch an Umweltfluktuationen anpassen und weitgehend nachhaltig im Ökosystem behaupten könnten.
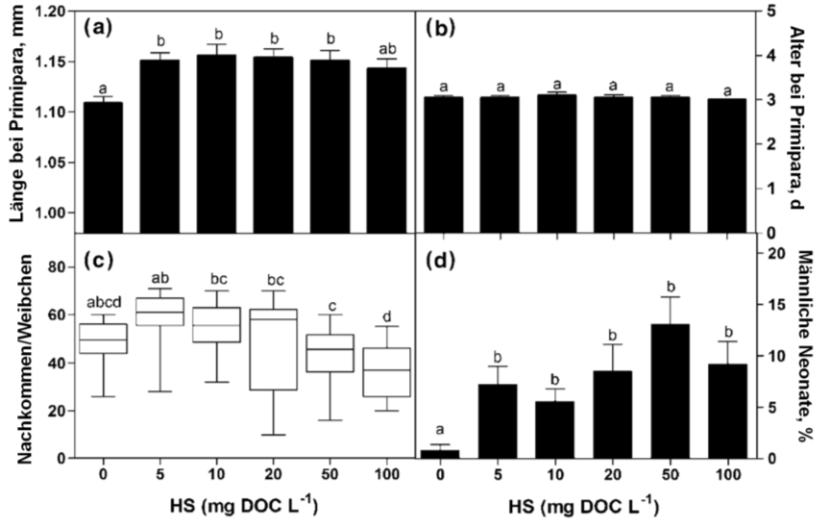 Abb. 10: Länge (a) und Alter (b) bei der ersten Brut (Primipara) von Moina macrocopa, Gesamtzahl der Nachkommen pro Weibchen (c) und Anteil neonater Männchen (d) entlang eines Huminstoff-Gradienten (Atoleiro-DOC). Unterschiedliche Kleinbuchstaben über den Säulen zeigen signifikante Unterschiede an (aus SUHETT et al. 2011, mit Genehmigung von Springer).
Abb. 10: Länge (a) und Alter (b) bei der ersten Brut (Primipara) von Moina macrocopa, Gesamtzahl der Nachkommen pro Weibchen (c) und Anteil neonater Männchen (d) entlang eines Huminstoff-Gradienten (Atoleiro-DOC). Unterschiedliche Kleinbuchstaben über den Säulen zeigen signifikante Unterschiede an (aus SUHETT et al. 2011, mit Genehmigung von Springer).
Die Exposition von M. macrocopa gegen Huminstoffe aus der Lagoa Atoleiro ließ die Tiere besser wachsen (Abb. 10a) und tendenziell mehr Nachkommen bekommen (Abb. 10c), veränderte aber nicht die Zeit, die die weiblichen Tiere bis zur ersten Brut benötigten (Abb. 10b). Das heißt, dass das verstärkte Wachstum nicht durch einen Nachteil in einer anderen Lebensvariablen erkauft wurde. Die höchsten Expositionskonzentrationen wirkten, gemessen an den Nachkommenzahlen und dem Geschlechterverhältnis, tendenziell toxisch. Jede Exposition gegen Huminstoffe erhöhte den Anteil von Männchen unter den Neonaten (Abb. 10d). Männchen werden benötigt, um Dauereier zum Überdauern einer besonderen Stresssituation zu produzieren. Dies kann eine der möglichen Taktiken zur Existenz der Populationen in stark fluktuierenden Umwelten sein.
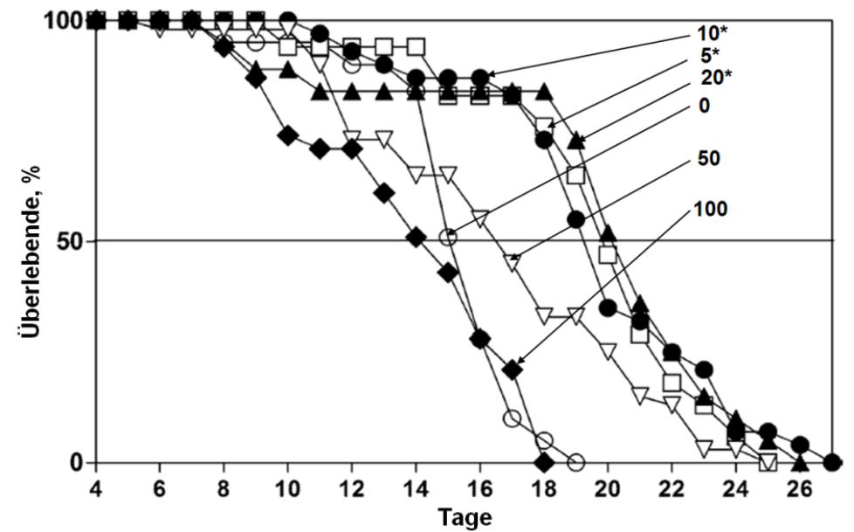 Abb. 11: Überlebenskurven von M.macrocopa-Weibchen entlang eines Huminstoff-Gradienten (Atoleiro-DOC, in mgL-1). * neben den Konzentrationsangaben zeigt signifikante Unterschiede zur Kontrolle an (aus SUHETT et al. 2011, mit Genehmigung von Springer).
Abb. 11: Überlebenskurven von M.macrocopa-Weibchen entlang eines Huminstoff-Gradienten (Atoleiro-DOC, in mgL-1). * neben den Konzentrationsangaben zeigt signifikante Unterschiede zur Kontrolle an (aus SUHETT et al. 2011, mit Genehmigung von Springer).
In einer geschützten Umwelt, also ohne Prädatoren, leben Weibchen normalerweise länger als Männchen. Männchen und Weibchen sind bis zum Ableben in der Lage, Dauereier zu produzieren. In einer Arbeit mit Daphnia magna war ermittelt worden, dass unter Huminstoff-Stress die Männchen ihre Lebensspanne verlängerten (EUENT et al. 2008). Dadurch wird die Gelegenheit zur Produktion von Dauereiern zeitlich erweitert und die Chance vergrößert, dass die Population langfristig erhalten bleibt. Wahrscheinlich gilt Ähnliches auch für Moina, wurde bislang aber nicht untersucht.
Erwartungsgemäß wuchsen huminstoffexponierte Moina besser als Tiere in huminstofffreiem Medium, und zwar wiederum entsprechend einer hormetischen Dosis-Wirkungs-Beziehung (Abb. 11). Mit Huminstoff-Konzentrationen bis 20 mg L-1 DOC lebten die Tiere im Mittel bis zu 30 % länger als nicht exponierte Tiere.
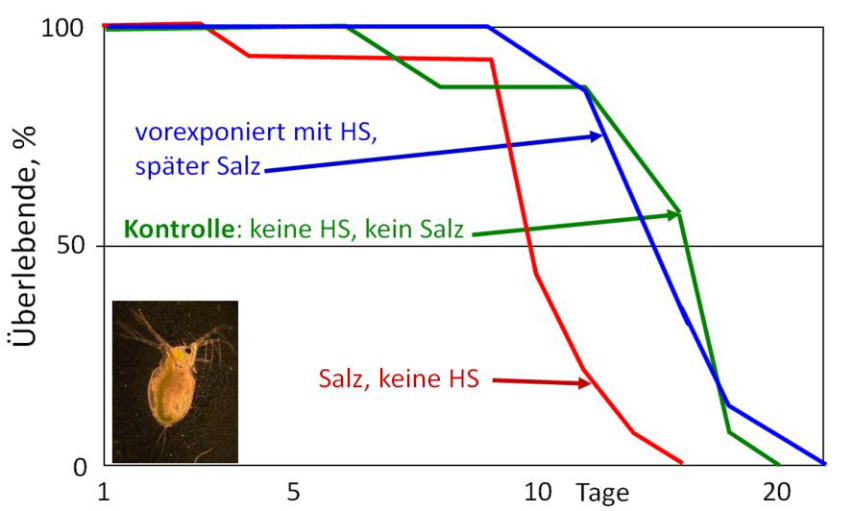 Abb. 12: Überlebenskurven von salz-gestressten M. macrocopa-Weibchen. Eine Gruppe wurde gegen Huminstoffe (Atoleiro-DOC) vorexponiert (SUHETT & STEINBERG unveröffentlicht).
Abb. 12: Überlebenskurven von salz-gestressten M. macrocopa-Weibchen. Eine Gruppe wurde gegen Huminstoffe (Atoleiro-DOC) vorexponiert (SUHETT & STEINBERG unveröffentlicht).
Wie verhielten sich die Tiere nun, wenn ein Einbruch des Atlantischen Ozeans simuliert wurde? Dazu wurde vor der Salz-Exposition eine Exposition gegen Huminstoffe vorgenommen (Abb. 12). Salzexposition verkürzte deutlich die Lebensdauer von M. macrocopa auf im Mittel rund 10 Tage. Wurden die Tiere nun gegen Huminstoffe vorexponiert, dann wurde der osmotische Stress ertragen und die Tiere lebten so lange wie in der unbelasteten Kontrolle. Es hatte sich eine multiple Stresstoleranz (oder Kreuztoleranz) herausgebildet.
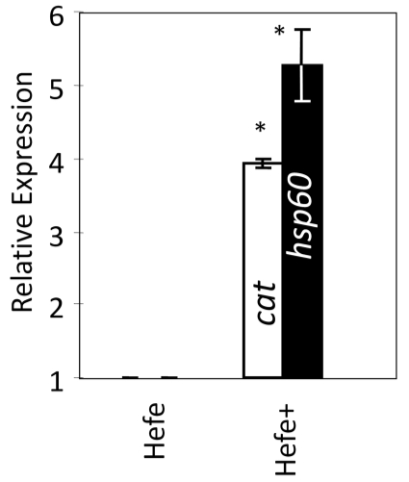 Abb. 13: Relative Transkription von zwei stress-responsiven Genen, dem Catalase-Gen und dem Heat-Shock-Protein-60-Gen, im Großen Wasserfloh, der mit Backhefe gefüttert wurde. Wurde er zusätzlich gegen 0,04 mM DOC eines Huminstoffes exponiert (gekennzeichnet mit +), erhöhte sich die Gentranskription deutlich (modifiziert nach STEINBERG et al. 2010, mit Genehmigung von Springer).
Abb. 13: Relative Transkription von zwei stress-responsiven Genen, dem Catalase-Gen und dem Heat-Shock-Protein-60-Gen, im Großen Wasserfloh, der mit Backhefe gefüttert wurde. Wurde er zusätzlich gegen 0,04 mM DOC eines Huminstoffes exponiert (gekennzeichnet mit +), erhöhte sich die Gentranskription deutlich (modifiziert nach STEINBERG et al. 2010, mit Genehmigung von Springer).
Diese Kreuztoleranz ermöglicht es Moina, in den stark fluktuierenden und stresshaften Küstenlagunen dauerhaft Populationen aufzubauen. Nach allen bisher vorliegenden Berichten ist der häufigste Mechanismus der Kreuztoleranz die Erhöhung von Stressproteinen (STEINBERG 2012). Dieser Mechanismus scheint auch bei den Cladoceren Gültigkeit zu haben, wie an Daphnia magna nachgewiesen wurde (STEINBERG et al. 2010). In diesem Versuch wurden die Wasserflöhe nur mit Backhefe gefüttert, was selbst schon zu verminderter antioxidativer Kapazität (einem oxidativen Stress) führte. Wurden die Tiere zusätzlich gegen 0.04 mM DOC eines Huminstoff-Präparates exponiert - eine durchaus auch für so genannte Klarwasserseen relevante Konzentration -, dann wurde die Gentranskription signifikant verstärkt (Abb. 13). HSP60 ist das Äquivalent in D. magna zu HSP70 in anderen Tieren und das universelle Stressprotein, das auf fast alle umweltbezogene und interne Stressoren reagiert und eine wesentliche Rolle im „gesunden“ Altern spielt (STEINBERG 2012).
Derartige durch Huminstoffe vermittelte Kreuztoleranzen wurden zwischenzeitlich mehrfach nachgewiesen. Extreme Beispiele kommen aus einem australischen Bergbaugebiet, in dessen Wasser Eintagsfliegen-Larven sowie Süßwassergarnelen (Caridina sp.) Säure aus den Abraumhalden (acid mine drainage) dank der Huminstoffe überleben (HOLLAND et al. 2014a, b).
9.5 - Durch Huminstoff induzierte Kreuztoleranzen sind nicht auf Wirbellose beschränkt
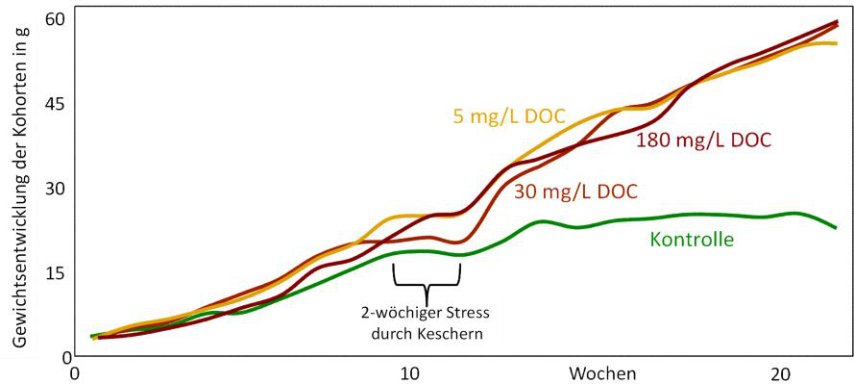 Abb. 14: Gewichtsentwicklung von Schwertträger-Jungtieren (Xiphophorus helleri) (modifiziert nach MEINELT et al. 2004, mit Genehmigung von Springer).
Abb. 14: Gewichtsentwicklung von Schwertträger-Jungtieren (Xiphophorus helleri) (modifiziert nach MEINELT et al. 2004, mit Genehmigung von Springer).
Ein weiteres Beispiel für eine Kreuztoleranz, die durch Huminstoffe hervorgerufen wurde, ist die Gewichtsentwicklung von Schwertträger-Nachwuchs (Xiphophorus helleri). Die frisch entlassenen Neugeborenen wurden in vier gleich große Gruppen unterteilt und gegen steigende Konzentrationen von Huminstoffen exponiert. Um die 10. Woche herum wurden die Tiere zwei Wochen lang einem starken Behandlungsstress unterworfen, sie wurden nämlich intensiv mit dem Kescher gejagt und umgesetzt. Dies kann mit einem intensiven Prädationsdruck gleichgesetzt werden. Die Kontrolltiere erholten sich nach dieser Tortur nicht mehr, denn ihre Gewichtszunahme war nur minimal (MEINELT et al. 2004). Waren aber Huminstoffe im Wasser vorhanden, dann setzte sich die Gewichtszunahme nach dem physikalischen Stress ungebremst fort (Abb. 14). Interessant ist, dass selbst die niedrigste Konzentration in dieser Serie (5 mg L-1 DOC) schon wirkte. In dieser Serie war keine Konzentrationsabhängigkeit der Wirkung erkennbar, sondern die Wirkung schien sich nach dem Alles-oder-Nichts-Prinzip zu vollziehen, wenn eine Mindestkonzentration im Wasser vorhanden war. Die niedrigste Konzentration im Versuch reicht offensichtlich aus, die Antistress-Antwort, wahrscheinlich die Produktion von HSP70, hervorzurufen. Diese ihrerseits wäre eine unspezifische Antwort auf eine Vielzahl von Stressoren, sodass sie nicht nur gegen Huminstoff-Expositionen, sondern auch selbst gegen das Gejagtwerden wappnet. Gejagtwerden kann letal enden, ist somit eine der härtesten Stresssituationen, die für ein Tier überhaupt denkbar ist. - Diese Ergebnisse wurden auf einer Tagung von Aquarien-Geschäftsleuten vorgetragen, die nachfolgend ihre Aquarien (einschließlich Verkaufsaquarien) kaum sichtbar mit Huminstoffen anreicherten (vergleichbar mit der 5 mg L-1-Variante). Der Erfolg war, dass die Ausfälle durch Tod in den Verkaufsaquarien deutlich minimiert werden konnten.
9.6 - Stresstoleranz pflanzt sich transgenerational fort
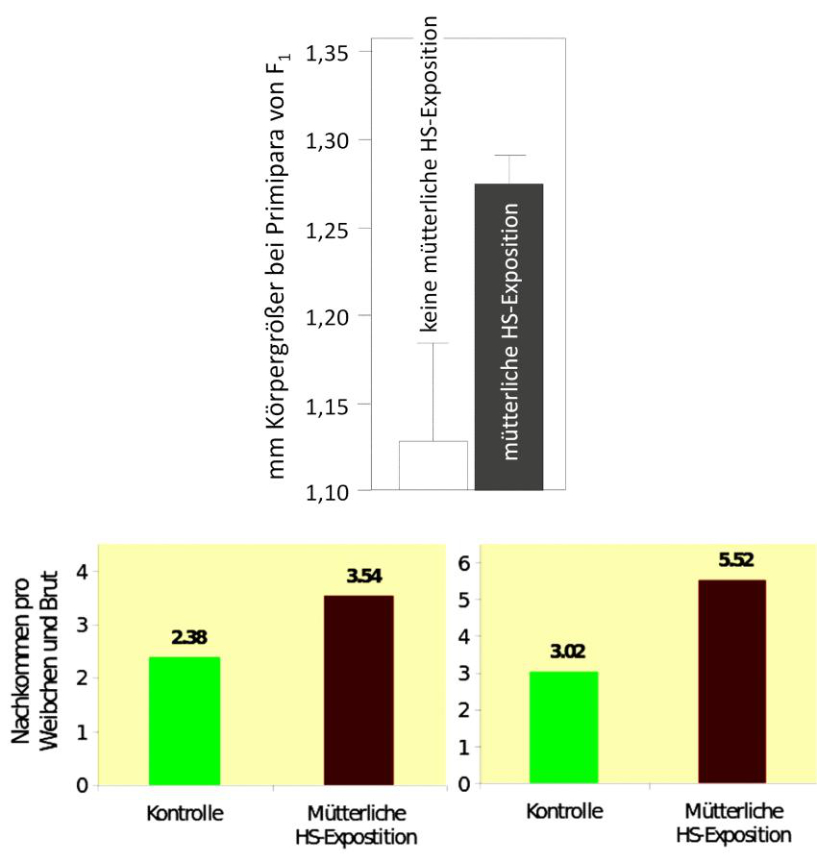 Abb. 15: Erhöhung der Körpergröße (oben) und der Nachkommenzahlen (unten) bei salzexponierten Moina macrocopa-Weibchen, wenn deren Mütter gegen Huminstoffe exponiert waren (oben: aus SUHETT et al. 2011, mit Genehmigung von Springer; unten: aus DACHSEL 2012).
Abb. 15: Erhöhung der Körpergröße (oben) und der Nachkommenzahlen (unten) bei salzexponierten Moina macrocopa-Weibchen, wenn deren Mütter gegen Huminstoffe exponiert waren (oben: aus SUHETT et al. 2011, mit Genehmigung von Springer; unten: aus DACHSEL 2012).
Besteht bereits in der individuellen Ausbildung von Kreuztoleranzen nach einem Stressor ein großer Vorteil für die augenblickliche Population, so potenziert er sich, wenn diese Toleranzen an nachfolgende Generationen weitergegeben werden können, ohne dass letztere selbst erst gestresst werden müssen oder gleichsam auf eine zufällige und damit ungerichtete Mutation zur Erhöhung der Stresstoleranz "warten" müssten. Ein Abwehrmechanismus, der gerichtet gegen den primären Stressor erworben wurde, gegen weitere Stressoren wappnet und sogar noch an nachfolgende Generationen weitergegeben werden kann, so lange die stresshafte Umwelt existiert, ist deutlich von Vorteil. Derartige Phänomene traten nach Huminstoff-Stress bei M. macrocopa tatsächlich auf und ließen sich aufgrund ihrer kurzen Generationsdauer gut verfolgen (SUHETT et al. 2011). Wuchsen huminstoffexponierte Moina-Weibchen bereits besser als in Kontrollen (Abb. 10a), so pflanzt sich dieser Effekt auf deren Töchter fort (Abb. 15). Doch damit ist hinsichtlich einer Populationsstabilisierung noch nichts gewonnen. Bei diesem Ansatz war durch das verwendete Expositions-Szenario nicht sicher, ob die Brut selbst durch die Huminstoffe imprägniert wurde oder ob sie Stressproteine von den Müttern erhalten hatte, die dauerhaft gegen Huminstoffe exponiert waren. In einem späteren Versuch (DACHSEL 2012) wurde zwischen der Huminstoff-Exposition der Mütter und den Töchtern, die auf Stressresistenz untersucht wurden, zwei Bruten abgewartet. Da die Produktion von Stressproteinen sehr energieaufwändig ist, war die Annahme, dass die Mütter in der Zeit der Nicht-Exposition die HSP-Produktion herunterfahren und gegebenenfalls die Kreuztoleranz epigenetisch weitergeben. Das Ergebnis bestätigt die positiven Effekte der Huminstoff-Exposition sehr deutlich: In zwei unabhängigen Versuchen reproduzierten salzexponierte Moina-Weibchen signifikant mehr, wenn ihre Mütter zuvor gegen Huminstoffe exponiert waren (Abb. 15). Auf diese Weise wird die Population nachhaltig gesichert.
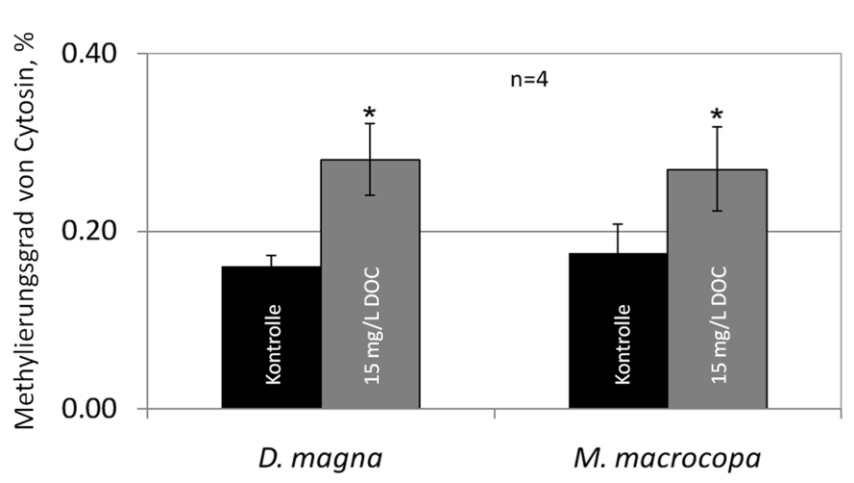 Abb. 16: Erhöhte Methylgehalte am Cytosin vor Guanin in Daphnia magna und Moina macrocopa nach Exposition gegen Huminstoffe (aus MENZEL et al. 2011, mit Genehmi- gung von Elsevier).
Abb. 16: Erhöhte Methylgehalte am Cytosin vor Guanin in Daphnia magna und Moina macrocopa nach Exposition gegen Huminstoffe (aus MENZEL et al. 2011, mit Genehmi- gung von Elsevier).
Welcher Mechanismus kann nun für die epigenetische Vererbung dieser Kreuztoleranz verantwortlich sein? Einer der häufigsten epigenetischen Mechanismen ist die Methylierung der DNA am Cytosin in der Stellung vor Guanin. Waren die beiden Cladoceren-Arten D.magna und M.macrocopa einem Huminstoff- Präparat ausgesetzt, war tatsächlich diese Position stärker methyliert als zuvor (Abb. 16). Das heißt, ein epigenetischer Mechanismus wird durch Huminstoffe angeschaltet (MENZEL et al. 2011). Welche Gene nun methyliert vorlagen, muss offenbleiben, da eine derartige Detailuntersuchung nicht durchgeführt wurde.
9.7 - Schlussbetrachtungen
Die wenigen in diesem Übersichtsbeitrag präsentierten Beispiele über die Auswirkungen von ökologischem Stress auf Tiere, hier durch Huminstoffe als einer weit verbreiteten Matrix jeden Ökosystems, belegen, dass Umweltstress zwar auf Individuen negativ wirken kann, aber in Hinsicht auf betreffende Populationen positiv sein kann. Diese Auswirkungen beinhalten verbessertes Wachstum, verlängerte Lebensspannen, erhöhte Nachkommenzahlen sowie multiple Stressresistenzen (Kreuztoleranzen). Über epigenetische Mechanismen können Kreuztoleranzen an nachfolgende Generationen weitergegeben werden. Im Gegensatz zu Mutationen sind dies gerichtete Mechanismen, die - solange die Stresssituationen bestehen - gegen diese Stressoren wappnen. Bestehen die Umwelt-Stressoren nicht mehr, werden diese Energie verbrauchenden Mechanismen wieder heruntergefahren. Da die durch Huminstoffe hervorgerufenen Stresssituationen nur eine von vielen möglichen Stressoren im Ökosystem sind, ist zu erwarten, dass sich die Tiere auch an die übrigen akklimatisiert haben, sofern diese ursprüngliche Stressoren sind (z. B. nicht anthropogene Xenobiotika) und die Zeit zur evolutiven Antwort ausreichend lang war. Es ist zu erwarten, dass weitere spannende Beispiele zur Stressakklimatisierung von aquatischen und terrestrischen Tieren herausgearbeitet werden können.
Danksagung: Der vorliegende Übersichtsbeitrag ist ohne die Mitarbeit, die Diskussionen oder Anregungen von vielen Leuten nicht denkbar. Als erstes gilt der Dank Frau Kollegin Irene ZERBST (FU Berlin), die unser Interesse auf den großartigen Baikal und seine faszinierende Fauna lenkte. Ferner sei den Mitgliedern und Studenten meiner Arbeitsgruppe an der Humboldt-Universität sowie denen der Kooperationspartner am IGB Berlin, in Rio de Janeiro und Macaé (Brasilien) und Irkutsk (Russland) ganz herzlich gedankt. Hoffentlich war die Arbeit mit mir nur Eustress. Mein besonderer, herzlicher Dank geht an Vasiliy PAVLICHENKO (Irkutsk) für die Überlassung der hervorragenden Amphipoden-Fotografien.
Literatur
BEREZINA, N. A., (2009): Interspecific interactions of amphipods Gammarus lacustris and Gmelinoides fasciatus. Russ. J. Ecol. 40: 81-85.
BITTNER, M.; SAUL, N. & STEINBERG, C. E. W. (2012): Antiandrogenic activity of humic substances. Sci. Total Environ. 432: 93-96.
BOHLEN, J.; FREYHOF, J. & NOLTE, A. (2008): Sex ratio and body size in Cobitis elongatoides and Sabanejewia balcanica (Cypriniformes, Cobitidae) from a thermal spring. Folia Zool. 57: 191-197.
CALABRESE, E. J. (2013): Hormetic mechanisms. Crit. Rev. Toxicol. 43: 580- 606.
- & BALDWIN, L. A. (2002): Defining hormesis. Hum. Exp. Toxicol. 21: 91-97.
CAZENAVE, J.; DE LOS ÁNGELES BISTONI, M.; ZWIRNMANN, E.; WUNDERLIN, D. A. & WIEGAND, C. (2006): Attenuating effects of natural organic matter on microcystin toxicity in zebra fish (Danio rerio) embryos - Benefits and costs of microcystin detoxication. Environ. Toxicol. 21: 22-32.
CELORIO-MANCERA, M. D. L. P.; AHN, S. J.; VOGEL, H. & HECKEL, D. G. (2011): Transcriptional responses underlying the hormetic and detrimental effects of the plant secondary metabolite gossypol on the generalist herbivore Helicoverpa armigera. BMC Genomics 12: art 575.
CLOSE, D. C. & MCARTHUR, C. (2002): Rethinking the role of many plant phenolics-protection from photodamage not herbivores? Oikos 99: 166-172.
CONOVER, D. O. & VAN VOORHEES, D. A. (1990): Evolution of a balanced sex ratio by frequency-dependent selection in a fish. Science 250: 1556- 1558.
DACHSEL, P. (2012): Transgenerations-Effekte bei der Stressantwort in Moina macrocopa. Diplomarbeit, Julius-Maximilians-Universität Würzburg.
ENGERT, A.; CHAKRABARTI, S.; SAUL, N.; BITTNER, M.; MENZEL, R. & STEINBERG, C. E. W. (2013): Interaction of temperature and an environmental stressor: Moina macrocopa responds with increased body size, increased lifespan, and increased offspring numbers slightly above its temperature optimum. Chemosphere 90: 2136-2141.
EUENT, S.; MENZEL, R. & STEINBERG, C. E. W. (2008): Gender-specific lifespan modulation in Daphnia magna by a dissolved humic substances preparation. Ann. Environ. Sci. 2: 7-10.
FISHER, R. A. (1930): The Genetical Theory of Natural Selection. University Press, Oxford.
HENSCHLER, D. (2006): The origin of hormesis: Historical background and driving forces. Hum. Exp. Toxicol. 25: 347-351.
HERMELINK, B.; URBATZKA, R.; WIEGAND, C.; PFLUGMACHER, S.; LUTZ, I. & KLOAS, W. (2010): Aqueous leaf extracts display endocrine activities in vitro and disrupt sexual differentiation of male Xenopus laevis tadpoles in vivo. Gen. Comp. Endocrinol. 168: 245-255.
HOLLAND, A.; DUIVENVOORDEN, L. J. & KINNEAR, S. H. W. (2014a): Humic substances of varying types increase survivorship of the freshwater shrimp Caridina sp. D to acid mine drainage. Ecotoxicology 23: 939- 945.
- ; DUIVENVOORDEN, L. J. & KINNEAR, S. H. W. (2014b): Humic substances: The answer to improved mayfly survivorship in acidic environments? Limnologica 48: 11-15.
HÖSS, S.; BERGTOLD, M.; HAITZER, M.; TRAUNSPURGER, W. & STEINBERG, C. E. W. (2001): Refractory dissolved organic matter can influence the reproduction of Caenorhabditis elegans (Nematoda). Freshw. Biol. 46: 1-10.
JÖNSSON, M.; RANÅKER, L.; ANDERS NILSSON, P. & BRÖNMARK, C. (2012): Prey-type-dependent foraging of young-of-the-year fish in turbid and humic environments. Ecol. Freshw. Fish. 21: 461-468.
LUTZ, I.; JIE, Z.; OPITZ, R.; KLOAS, W.; YING, X.; MENZEL, R. & STEINBERG, C. E. W. (2005): Environmental signals: synthetic humic substances act as xeno-estrogen and affect the thyroid system of Xenopus laevis. Chemosphere 61: 1183-1188.
MEINELT, T.; PAUL, A.; PHAN, T. M.; ZWIRNMANN, E.; KRÜGER, A.; WIENKE, A. & STEINBERG, C. E. W. (2007): Reduction in vegetative growth of the water mold Saprolegnia parasitica (Coker) by humic substance of different qualities. Aquat. Toxicol. 83: 93-103. 162
- ; SCHRECKENBACH, K.; KNOPF, K.; WIENKE, A.; STÜBER, A. & STEINBERG, C. E. W. (2004): Humic substances affect physiological condition and sex ratio of swordtail (Xiphophorus helleri Heckel). Aquat. Sci. 66: 239- 245.
MENZEL, R.; STÜRZENBAUM, S.; BÄRENWALDT, A.; KULAS, J. & STEINBERG, C. E. W. (2005): Humic material induces behavioral and global transcriptional responses in the nematode Caenorhabditis elegans. Environ. Sci. Technol. 39: 8324-8332.
MENZEL, S.; BOUCHNAK, R.; MENZEL, R. & STEINBERG, C. E. W. (2011): Dissolved humic substances initiate DNA-methylation in cladocerans. Aquat. Toxicol. 105: 640-642.
PANDIAN, T. J. (1970): Intake and coversion of food in the fish Limanda limanda exposed to different temperatures. Mar. Biol. 5: 1-17.
PROTOPOPOVA, M. V.; PAVLICHENKO, V. V.; MENZEL, R.; PUTSCHEW, A.; LUCKENBACH, T. & STEINBERG, C. E. W. (2014): Contrasting cellular stress responses of Baikalian and Palearctic amphipods upon exposure to humic substances: environmental implications. Environ. Sci. Pollut. Res. 21: 14124-14137.
REEMTSMA, T. & THESE, A. (2005): Comparative investigation of low-molecular-weight fulvic acids of different origin by SEC-Q-TOF-MS: New insights into structure and formation. Environ. Sci. Technol. 39: 3507-3512.
RISTOW, M. & SCHMEISSER, K. (2014): Mitohormesis: Promoting health and lifespan by increased levels of reactive oxygen species (ROS). Dose- Resp. 12: 288-341.
ROOD, F. H. & REZNICK, D. N. (1997): Variation in the demography of guppy populations: The importance of predation and life histories. Ecology 78: 405-418.
SAUL, N.; PIETSCH, K.; MENZEL, R.; STÜRZENBAUM, S. R. & STEINBERG, C. E. W. (2010): The longevity effect of tannic acid in Caenorhabditis elegans: Disposable Soma meets hormesis. J. Gerontol. A 65 A: 626- 635.
SCHULZ, T. J.; ZARSE, K.; VOIGT, A.; URBAN, N.; BIRRINGER, M. & RISTOW, M. (2007): Glucose restriction extends Caenorhabditis elegans life span by inducing mitochondrial respiration and increasing oxidative stress. Cell Metab. 6: 280-293.
SELYE, H. (1936): A syndrome produced by diverse nocuous agents. Nature 138: 32.
- (1955): Stress and disease. Science 122: 625-631.
STEINBERG, C. E. W. (2012): Stress Ecology - Environmental Stress as Ecological Driving Force and Key Player in Evolution. Springer, Dordrecht.
- ; OUERGHEMMI, N.; HERRMANN, S.; BOUCHNAK, R.; TIMOFEYEV, M. A. & MENZEL, R. (2010): Stress by poor food quality and exposure to humic substances: Daphnia magna responds with oxidative stress, lifespan extension, but reduced offspring numbers. Hydrobiologia 652: 223- 236.
- ; PAUL, A.; PFLUGMACHER, S.; MEINELT, T.; KLÖCKING, R. & WIEGAND, C. (2003): Pure humic substances have the potential to act as xenobiotic chemicals - a review. Fresenius Environ. Bull. 12: 391-401.
- ; PIETSCH, K.; SAUL, N.; MENZEL, S.; SWAIN, S.; STÜRZENBAUM, S. R. & MENZEL, R. (2013): Transcript expression patterns illuminate the mechanistic background of hormesis in Caenorhabditis elegans Maupas. Dose-Response 11: 558-576.
- ; SAUL, N.; PIETSCH, K.; MEINELT, T.; RIENAU, S. & MENZEL, R. (2007): Dissolved humic substances facilitate fish life in extreme aquatic environments and have the potential to extend lifespan of Caenorhabditis elegans. Ann. Environ. Sci. 1: 81-90.
SUHETT, A. L.; STEINBERG, C. E. W.; SANTANGELO, J. M.; BOZELLI, R. L. & FARJALLA, V. F. (2011): Natural dissolved humic substances increase the lifespan and promote transgenerational resistance to salt stress in the cladoceran Moina macrocopa. Environ. Sci. Pollut. Res. 18: 1004- 1014.
TIMOFEYEV, M. A. & STEINBERG, C. E. W. (2006): Antioxidant response to natural organic matter (NOM) exposure in three Baikalean amphipod species from contrasting habitats. Comp. Biochem. Physiol. B 145: 197-203.
WETZEL, R. G. (2001): Limnology. Lake and River Ecosystems. 3rd ed. Academic Press, San Diego.
Literatur
Bertolo, A. & Magnan, P. (2007): Logging-induced variations in dissolved organic carbon affect yellow perch (Perca flavescens) recruitment in Canadina Shield Lakes. Can. J. Fish Aqu. Sci. 64: 181-186.
Bittner M, Saul N, Steinberg CEW (2012) Antiandrogenic activity of humic substances. Sci Total Environ 432:93–96.
Holland A, Duivenvoorden LJ, Kinnear SHW (2013a) Humic substances increase survival of freshwater shrimp Caridina sp. D to acid mine drainage. Arch Environ Contam Toxicol 64 (2):263–272.
Holland A, Duivenvoorden LJ, Kinnear SHW (2013b) Humic substances increase the survivorship rates of freshwater shrimp exposed to acidified waters of varying hardness. Ann Environ Sci 7:49–58.
Holland A, Duivenvoorden LJ, Kinnear SHW (2014c) Humic substances of varying types increase survivorship of the freshwater shrimp Caridina sp. D to acid mine drainage. Ecotoxicology 23 (5):939-945.
Laue P, Bährs H, Chakrabarti S, Steinberg CEW (2014) Natural xenobiotics to prevent cyanobacterial and algal growth in freshwater: Contrasting efficacy of tannic acid, gallic acid, and gramine. Chemosphere 104:212-220.
Lieke T, Steinberg CEW, Bittmann S, Behrens S, Hoseinifar SH, Meinelt T, Knopf K, Kloas W (2021a) Fulvic acid accelerates hatching and stimulates antioxidative protection and the innate immune response in zebrafish larvae. Sci Total Environ 796. 148780.
Lieke T, Steinberg CEW, Pan B, Perminova IV, Meinelt T, Knopf K, Kloas W (2021b) Phenol-rich fulvic acid as a water additive enhances growth, reduces stress, and stimulates the immune system of fish in aquaculture. Sci Rep 11 (1):174.
Lutz I, Jie Z, Opitz R, Kloas W, Ying X, Menzel R, Steinberg CEW (2005) Environmental signals: synthetic humic substances act as xeno-estrogen and affect the thyroid system of Xenopus laevis. Chemosphere 61 (8):1183–1188.
Meinelt T, Schreckenbach K, Knopf K, Wienke A, Stüber A, Steinberg CEW (2004) Humic substances affect physiological condition and sex ratio of swordtail (Xiphophorus helleri Heckel). Aquat Sci 66 (2):239–245.
Meinelt T, Schreckenbach K, Pietrock M, Heidrich S, Steinberg CEW (2008) Humic substances (review series). Part 1: Dissolved humic substances (HS) in aquaculture and ornamental fish breeding. Environ Sci Pollut Res 15 (1):17–22.
Menzel R, Stürzenbaum S, Bärenwaldt A, Kulas J, Steinberg CEW (2005) Humic material induces behavioral and global transcriptional responses in the nematode Caenorhabditis elegans. Environ Sci Technol 39 (21):8324–8332.
Menzel S, Bouchnak R, Menzel R, Steinberg CEW (2011b) Dissolved humic substances initiate DNA- methylation in cladocerans. Aquat Toxicol 105 (3–4):640–642.
Pörs Y, Steinberg CEW (2012) Humic substances delay aging of the photosynthetic apparatus of Chara hispida J Phycol 48 (6):1522–1529.
Steinberg CEW, Höss S, Kloas W, Lutz I, Meinelt T, Pflugmacher S, Wiegand C (2004) Hormonelike effects of humic substances on fish, amphibians, and invertebrates. Environ Toxicol 19 (4):409- 411.
Steinberg CEW, Paul A, Pflugmacher S, Meinelt T, Klöcking R, Wiegand C (2003) Pure humic substances have the potential to act as xenobiotic chemicals – A review. Fresenius Environ Bull 12 (5):391– 401.
Steinberg CEW, Saul N, Pietsch K, Meinelt T, Rienau S, Menzel R (2007) Dissolved humic substances facilitate fish life in extreme aquatic environments and have the potential to extend lifespan of Caenorhabditis elegans. Ann Environ Sci 1:81–90.
Suhett AL, Steinberg CEW, Santangelo JM, Bozelli RL, Farjalla VF (2011) Natural dissolved humic substances increase the lifespan and promote transgenerational resistance to salt stress in the cladoceran Moina macrocopa. Environ Sci Pollut Res 18 (6):1004–1014.
Sylvain F-É, Leroux N, Normandeau E, Custodio J, Mercier P-L, Bouslama S, Holland A, Barroso D, Val AL, Derome N (2022) Fish-microbe systems in the hostile but highly biodiverse Amazonian blackwaters. bioRxiv:2022.2010.2022.513327.


