Die Karbonathärte (KH) ist nach allgemeiner Definition der Anteil an Erdalkali-Ionen, die an Carbonate (CO32-) und Hydrogencarbonate (HCO3-) gebunden und im Wasser gelöst sind. Somit ist sie ein Teil der Gesamthärte (GH). Die in der Aquaristik verwendete und für uns relevante "aquaristische" Karbonathärte (KH) bezieht jedoch alle Carbonat-Ionen und Hydrogencarbonat-Ionen mit ein, nicht nur die Erdalkali-Ionen. Sie beschreibt daher die Säurekapazität, bzw. das Säurebindungsvermögen (SBV) (engl.: acid-neutralizing capacities) und ist praktisch ausgedrückt die Menge an Salzsäure, die man brauchen würde, um das Wasser auf einen pH von 4,3 zu bringen. Erdalkalimetalle sind die stabilen Elemente Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr) und Barium (Ba), wobei in der Aquaristik Magnesium und Calcium in deutlich höheren Mengen relevant sind als Ionen von Strontium, Beryllium und Barium, die im Wasser in der Regel nur in Spuren vorkommen.
1 Zusammenhänge: pH, KH und CO2
Im Aquarium sind der pH-Wert, die Karbonathärte und der CO2-Gehalt kaum zu trennen, da sich diese Werte gegenseitig beeinflussen. Die größte Rolle spielt hier die Karbonathärte: Sie ist ein wichtiger pH-Puffer und stabilisiert diesen, sodass dieser nicht so leicht durch verschiedenste Einflüsse wie organische Säuren oder Kohlenstoffdioxid (CO2) zum Schwanken kommt.
2 Erkenntnisse
Die folgenden für Aquarien relevanten Erkenntnisse stehen in direktem Zusammenhang mit der Karbonathärte beziehungsweise dem Säurebindungsvermögen:
Das für viele Tiere notwendige „saure Wasser“ ist nur mit einer niedrigen Karbonathärte möglich.
Durch eine niedrige KH ist auch das Säurebindungsvermögen niedrig, somit kann alleine durch organische Säuren der pH weit gesenkt werden.
Dieses weiche, saure Wasser kann beispielsweise durch den Einsatz starker (mineralischer) Säuren wie zum Beispiel Salzsäure erreicht werden. Diese brechen die Karbonathärte in ihre Bestandteile auf (es entsteht Kohlenstoffdioxid & die KH sinkt), wodurch gleichzeitig auch der pH-Wert nach unten geht.
3 Berechnung: Der Einfluss der KH auf den pH-Wert ist berechenbar
KH – pH – CO2 — ändert man einen dieser Werte, ändern sich auch die anderen beiden. Dieses Zusammenspiel ist sehr gut in folgender Tabelle ersichtlich:
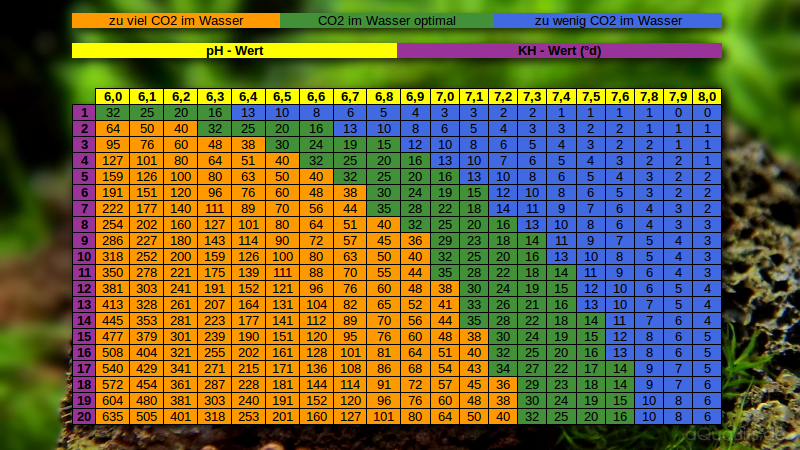
Tabelle mit freundlicher Genehmigung von Günther Bittner von aquabits.de
Folglich lässt sich ein unbekannter Wert durch zwei bekannte Werte herausfinden. Sind z.B. KH und pH bekannt, lässt sich der CO2-Gehalt des Wassers durch folgende Formel errechnen:
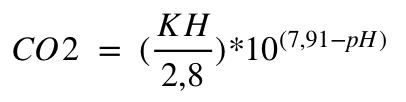
Rein rechnerisch erhöht also eine Verdoppelung der KH bei einem gleichbleibenden CO2-Wert den pH um 0,3; in der Praxis jedoch gibt es noch viel mehr Einflüsse auf diese drei Faktoren. Vor allem organische Säuren und andere mineralische/organische Einträge, beispielsweise durch Futter, Laub, Bodengrund oder Wurzeln, verändern die einzelnen Parameter, weswegen eine exakte Berechnung in der Praxis nicht möglich ist.
4 Messung: die Karbonathärte messen
Grundsätzlich gibt es zwei Methoden, die KH zu messen: mittels Tröpfchentest oder Streifentest.
Die Vorteile des Streifentests sind die sehr einfache Handhabung und schnelle Anwendung. Für die Aquaristik gibt es solch einen Test meist in Kombination mit anderen Werten wie GH, pH, Nitrit und Nitrat. Diese Tests sind leider nur sehr eingeschränkt zu empfehlen, da sich durch verschiedene Faktoren das Messergebnis stark verfälschen kann:
- bei zu langer oder falscher Lagerung beginnen die Stoffe schon in der Verpackung mit der Reaktion und verfälschen so letztendlich das Ergebnis
- Chemikalien verrinnen beim Messen ineinander
- Ablesbarkeit eines Werts oft nicht möglich
- zu geringe Anzahl der Indikatorfelder
- bei Messung mittels Software oder App: verschiedene Lichtverhältnisse können zu verfälschten Ergebnissen führen
Es gibt Teststreifen für den Laborbedarf, diese sind alleine für die Karbonathärte mit 5-6 Feldern ausgestattet und ermöglichen so durch verschiedene Farbkombinationen ein relativ genaues Ablesen des Wertes. Sie sind den der explizit für die Aquaristik beschriebenen Teststreifen vorzuziehen.
Generell sind Tröpfchentests wie von JBL, Tetra, Dennerle oder Wasserpantscher um ein vielfaches genauer abzulesen als Teststreifen. Die Anwendung ist einfach: man tropft Indikatorlösung in das Testwasser, bis die Farbe umschlägt, die Anzahl der Tropfen bis zum Umschlag entspricht der Karbonathärte.
5 KH größer als GH: Kann die Karbonathärte (KH) größer als die Gesamthärte (GH) sein?
Wie oben beschrieben unterscheiden wir in "echte" Karbonathärte und "aquaristische" Karbonathärte.
Die "echte" Karbonathärte (KH) ist der Anteil an Erdalkali-Ionen, die an Carbonate (CO32-) und Hydrogencarbonate (HCO3-) gebunden und im Wasser gelöst sind. Sie ist somit ein Teil der Gesamthärte (GH), die aus der Konzentration aller Erdalkali-Ionen besteht und kann daher nicht größer als die GH sein.
Die "aquaristische" Karbonathärte (KH) bezieht alle Carbonat-Ionen und Hydrogencarbonat-Ionen mit ein, nicht nur die Carbonate und Hydrogencarbonate der „echten“ KH. Sie beschreibt daher die Säurekapazität, bzw. das Säurebindungsvermögen (SBV) und als solche kann sie in einigen Fällen größer als die GH sein. Z.B. dann, wenn durch eine Haus-Enthärtungsanlage (Ionentauscher) nicht nur Calcium und Magnesium reduziert werden, sondern zum Schutz von Wasserleitungen Natrium hinzugegeben wird. Das Natriumhydrogencarbonat (NaHCO3) im Wasser wird bei KH-Tests mit erfasst und somit kann die "aquaristische" KH, oder richtiger, das Säurebindungsvermögen (SBV) größer als die GH sein.
Autor(en)
Ricardo Castellanos, Carsten Logemann

